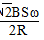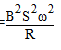问题
选择题
已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
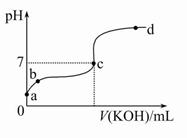
(1)a点溶液中c(H+)为 。
(2)b点溶液中离子浓度大小顺序为 或 或 。c点溶液中的离子浓度大小顺序为 。
(3)a、b、c三点中水的电离程度最大的是 ,滴定过程中宜选用 作指示剂。
答案
(1)4×10-4 mol·L-1
(2)c(CH3COO-)>c(H+)>c(K+)>c(OH-)
c(CH3COO-)>c(H+)=c(K+)>c(OH-)
c(CH3COO-)>c(K+)>c(H+)>c(OH-)
c(K+)=c(CH3COO-)>c(H+)=c(OH-)
(3)c 酚酞
(1)c(H+)=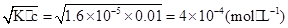
(2)b点时,由于滴加KOH溶液的体积未知,因此,溶液中的c(K+)与c(H+)相对大小未知,所以有3种可能情况。c点时可根据电荷守恒得出关系式。
(3)酸性溶液中水的电离被抑制,加入可水解的盐能促进水的电离,随着KOH的加入(c点时,KOH还未过量),溶液中CH3COOK的量不断增多,因此水的电离过程不断增大,故c点符合题意。由于酸碱恰好完全反应时溶液显碱性,故应该选择碱性范围内变色的指示剂酚酞。

 cosωt
cosωt