(13分)难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡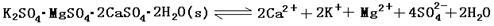
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
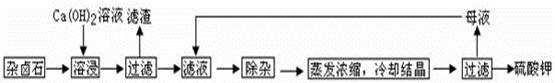
(1)滤渣主要成分有 和 以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因: 。
(3)“除杂”环节中,先加入 溶液,经搅拌等操作后,过滤,再加入 溶液调滤液PH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图14,由图可得,随着温度升高,
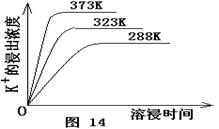
① 在相同时间K+的浸出浓度大。
② 在相同时间K+的浸出浓度减小
③ 反应的速率加快,平衡时溶浸时间短。
④ 反应速率减慢,平衡时溶浸时间增长。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:

已知298K时, Ksp(CaCO3)=2.80×10—9, Ksp(CaSO4)=4.90×10—5 ,求此温度下该反应的平衡常数K 。
(1)CaSO4(1分) Mg(OH)2(1分)
(2)氢氧根与镁离子结合,使平衡向右移动,K+变多。(2分)
(3)K2CO3 (2分) H2SO4 (2分)
(4)①③(2分)
(5)K=1.75×104(3分)
题目分析:(1)根据题目给出的可逆溶解平衡,加Ca(OH)2后,Mg 2+变成Mg(OH)2,硫酸钙是微溶物,因此滤渣成分是Mg(OH)2,CaSO4和未溶杂卤石;(2)根据勒夏特列原理,加入Ca(OH)2后,Mg 2+不断沉淀,硫酸钙也析出,平衡正移,因此浸出K+;(3)为了使生成的硫酸钾最纯,要除去加入的过量的氢氧化钙,而进入杂质阳离子,因此加入碳酸钾,最后硫酸钾除去过量的碳酸钾且调节溶液pH值;(4)由已知曲线图观察可知,升高温度可以提高K+浸出率,缩短浸出时间;(5)由题意知:Ksp(CaCO3)=2.80×10-9=c(Ca2+)·c(CO32-),Ksp(CaSO4)=4.90×10-5=c(Ca2+)·c(SO42-),因此有:Ksp =1.75×104。
点评:本题在化学工艺流程的背景下对化学反应平衡进行考查,题目难度比较大,综合性较强。