问题
选择题
关于室温下下列溶液的说法不正确的是

A.水的电离程度:①=②=③=④
B.分别加水稀释10倍,溶液的pH:①>②>③>④
C.①、③两溶液等体积混合: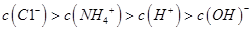
D.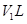 溶液②与
溶液②与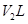 溶液③混合,若
溶液③混合,若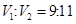 ,则混合溶液pH=4(忽略溶液体积变化)
,则混合溶液pH=4(忽略溶液体积变化)
答案
答案:C
题目分析:A、氨水、NaOH溶液的pH为11,则OH‾浓度为10-3mol•L‾1,pH=3的盐酸和醋酸溶液中H+浓度为10-3mol•L‾1,对水的电离影响相同,正确;B、加水稀释,弱电解质的电离平衡向右移动,所以溶液的pH:①>②>③>④,正确;C、①、③两溶液等体积混合,氨水大量过量,溶液溶质为NH3•H2O和NH4Cl,溶液显碱性,离子浓度大小顺序为:c(NH4+) > c(Cl‾)>c(OH‾)>c(H+),错误;D、HCl过量,混合溶液c(H+)=(V2•10-3mol—V1•10-3mol)/( V1+ V2)= 10-4mol•L‾1,所以pH=4,正确。
