(8分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)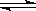 CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表,回答下列问题:
CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表,回答下列问题:
| T℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应正向为ΔH 0;若该反应符合如图所示的关系,则在图中,Y轴是指 。 (答出一种即可)

(2)能判断该反应达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v (H2)正=v (H2O)逆 d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式: 0.9·c(CO2)·c(H2)=c(CO)·c(H2O),由此可以判断此时的温度为 ℃。其它条件不变,升高温度,原化学平衡向 反应方向移动(填“正”或“逆”),容器内混合气体的平均相对分子质量 (填“增大”、“减小”或“不变”)。
(1)>;CO2或H2的百分含量(2)b、c(3)800℃;正;不变
题目分析:(1)K随温度升高而增大,所以正反应是吸热反应。图中随着温度升高,Y轴代表的物理量减小,Y轴可表示CO2或H2的百分含量。
(2)该反应各物质都是气体且反应前后化学计量数不变,所以不管是否平衡压强都不变,a错误;混合气体中c(CO)不变证明反应达到平衡状态;反应中H2和H2O速率相等,所以v (H2)正=v (H2O)逆证明反应达到平衡状态;c(CO2)、c(CO)浓度不变可说明反应达到平衡状态,而不是二者浓度相等,D错误。
(3)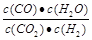 =K=0.9,此时温度为800℃;升高温度,平衡向正反应方向移动,但气体的m和n均不变,所以平均相对分子质量不变。
=K=0.9,此时温度为800℃;升高温度,平衡向正反应方向移动,但气体的m和n均不变,所以平均相对分子质量不变。
点评:平衡常数是温度的函数,学会利用平衡常数判断反应的热效应。
