现有浓度均为0.1 mol/L的下列溶液:
①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵
请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________。
(2)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是____。
(3)已知T ℃,KW=1×10-13,则t ℃________(填“>”、“<”或“=”)25℃。在T℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=________。
(4)25℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和,求:
①若x+y=14,则a/b=________(填数据);
②若x+y=13,则a/b=________(填数据);
③若x+y>14,则a/b=________(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的pH(x、y)的关系式为__(填表达式)。
(1)④②③①
(2)c(Na+)=c(Cl-)>c(OH-)>c(NH4+)>c(H+)
(3)> 101∶9
(4)①1 ②0.1 ③10x+y-14 ④x+y=14+lg(a/b)
(1)向溶液中加入酸或碱均能抑制H2O的电离,且溶液中H+或OH-浓度越大,由水电离出的H+浓度越小;盐的水解能促进水的电离,即由水电离出c(H+)的从大到小的顺序为④②③①。(2)二者完全反应生成NaCl和NH3·H2O,NH3·H2O电离使溶液呈碱性,即c(Na+)=c(Cl-)>c(OH-)>c(NH4+)>c(H+)。(3)温度升高时KW增大,T℃时KW>1×10-14,即T℃>25℃;NaOH溶液中n(OH-)=0.01a mol,H2SO4中n(H+)=0.1bmol ,根据混合后溶液pH=10,得10-3=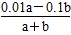 解得a:b=101∶9。(4)两溶液完全中和,则溶液中n(H+)=c(OH-),即10-xa=10y-14b,整理得
解得a:b=101∶9。(4)两溶液完全中和,则溶液中n(H+)=c(OH-),即10-xa=10y-14b,整理得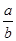 =10x+y-14,①若x+y=14时,a/b=1;②若x+y=13,则a/b=0.1;③若x+y>14,则a/b=10x+y-14;④两溶液完全中和,则有
=10x+y-14,①若x+y=14时,a/b=1;②若x+y=13,则a/b=0.1;③若x+y>14,则a/b=10x+y-14;④两溶液完全中和,则有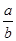 =10x+y-14即lg(a/b)=x+y-14,解得x+y=14+lg(a/b)。
=10x+y-14即lg(a/b)=x+y-14,解得x+y=14+lg(a/b)。
