哈伯因发明了氮气和氢气合成氨气的方法而获得1918年的诺贝尔化学奖,
N2(g)+3H2(g) 2NH3(g) △H<0。下图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:
2NH3(g) △H<0。下图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:
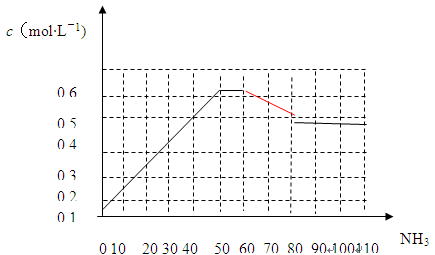
(1)此反应在50~60s时化学平衡常数为K1 = (列出计算式不用试算)。
(2)反应进行到60s时,改变的条件可能是 。
A.加入催化剂
B.扩大容器的体积
C.升高温度
D.减小氨气的浓度在该条件下,氮气的化学反应速率 。(填“变小”、“变大”或“不变”)
(3)该反应在80s后化学平衡常数为K2,则K1 K2(填“>”、“<”或“=”),此时氮气的转化率为 。
(4)若在110s后向该平衡体系中再加入1mol氨气,则再次达平衡后,氨气在平衡体系中的体积分数 。(填“变小”、“变大”或“不变”)
(1)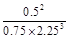 (2) C 变大 (3) > 20% (4)变大
(2) C 变大 (3) > 20% (4)变大
题目分析:(1)50~60s时,反应达到平衡状态。
N2(g)+3H2(g) 2NH3(g) △H<0
2NH3(g) △H<0
始(mol· L-1) 1 3
变(mol· L-1) 0.25 0.75 0.5
平(mol· L-1) 0.75 2.25 0.5
K= =
=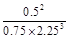 。
。
(2)60-80s时c(NH3)减小,后又达到平衡状态。催化剂对平衡移动无影响,A错误;扩大容器体积,c(NH3)瞬间减小,与原平衡不连续,B错误;升高温度,平衡向左移动,c(NH3)减小,C正确;减小氨气浓度,c(NH3)先减小先增大,D错误。
(3)该反应是放热反应,温度越高,K越小。80s后,c(NH3)=0.4mol·L-1,转化的N2为0.2mol,N2转化率为0.2。
(4)平衡后再加氨气,相当于定温定容时再充入N2和H2,等效于增大压强,平衡向右移动,氨气在平衡体系中体积分数增大。
点评:平衡常数与温度有关。
