问题
选择题
室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合溶液的pH=5,则下列说法(或关系式)正确的是
A.混合溶液中由水电离出的c(H+) =1×10-5 mol/L
B.c(A-) + c(HA) ="2c" (Na+) = 0.4 mol/L
C.HA溶液中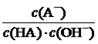 与上述混合溶液中
与上述混合溶液中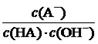 相等
相等
D.c(A-)-c(HA) =" 2" c (OH-)-2c (H+)
答案
答案:C
题目分析:根据题意知,室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合,所得溶液为0.1mol/L HA和0.1mol/L NaA的混合液,混合溶液的pH=5,则HA为弱酸,混合液中HA的电离程度大于NaA的水解程度。A、混合溶液中由水电离出的c(H+) =1×10-9 mol/L,错误;B、根据混合液中的物料守恒知,c(A-) + c(HA) ="2c" (Na+) = 0.2mol/L,错误;C、根据HA的电离常数表达式及水的离子积常数
表达式知,溶液中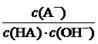 ="Ka(HA)/Kw" ,上述反应过程中,温度不变,Ka(HA)、Kw不变,故HA溶液中
="Ka(HA)/Kw" ,上述反应过程中,温度不变,Ka(HA)、Kw不变,故HA溶液中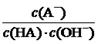 与上述混合溶液中
与上述混合溶液中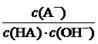 相等,正确;D、根据混合液中的物料守恒和电荷守恒式知,c(A-)-c(HA) ="2c" (H+)— 2 c (OH-),错误。
相等,正确;D、根据混合液中的物料守恒和电荷守恒式知,c(A-)-c(HA) ="2c" (H+)— 2 c (OH-),错误。
