(10分)某课外活动小组为了探究温度对化学平衡的影响,做了如下实验:
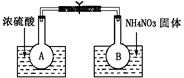
该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。已知2NO2(g) N2O4(g) ΔH(298K)=-52.7kJ·mol-1。
N2O4(g) ΔH(298K)=-52.7kJ·mol-1。
请回答:
(1)A中的现象 ,B中的现象 ;
(2)由此可知,降低温度,该化学平衡向 (填“正”或“逆”)反应方向移动;
(3)该化学反应的浓度平衡常数表达式为 ,升高温度,该反应中NO2的转化率将 (填“增大”、“减小”或“不变”)。
(1)气体颜色加深 气体颜色变浅 (2)正 (3)Kc = 减小
题目分析:(1)根据反应2NO2(g) N2O4(g) ΔH(298K)=-52.7kJ·mol-1,A中相当于加热,所以平衡逆向移动,气体颜色加深,B中相当于降温,所以平衡正向移动,气体颜色变浅。
N2O4(g) ΔH(298K)=-52.7kJ·mol-1,A中相当于加热,所以平衡逆向移动,气体颜色加深,B中相当于降温,所以平衡正向移动,气体颜色变浅。
(2)降温平衡正向移动。
(3)根据反应2NO2(g) N2O4(g)得K=,升高温度,平衡逆向移动,NO2的转化率减小。
N2O4(g)得K=,升高温度,平衡逆向移动,NO2的转化率减小。
点评:本题非常基础简单,主要考查化学平衡的基础知识。