(10分)(1)一定条件下,发生反应CO (g)+H2O (g)  CO2(g) +H2 (g),向2 L密闭容器中通入2 mol CO (g)、1 mol H2O (g),2 min后反应达到平衡时,测得CO的物质的量为1.6mol,用H2O (g)表示该反应速率为________此温度下,该反应的平衡常数为________若往容器中再加入2 mol CO (g),则重新达到平衡时的CO总转化率________20%(填“>”、“<”或“=”)。
CO2(g) +H2 (g),向2 L密闭容器中通入2 mol CO (g)、1 mol H2O (g),2 min后反应达到平衡时,测得CO的物质的量为1.6mol,用H2O (g)表示该反应速率为________此温度下,该反应的平衡常数为________若往容器中再加入2 mol CO (g),则重新达到平衡时的CO总转化率________20%(填“>”、“<”或“=”)。
(2)在一密闭容器中发生反应 2 NO2 2NO+O2 ΔH>0,反应过程中NO2的浓度随时间变化的情况如下图所示。
2NO+O2 ΔH>0,反应过程中NO2的浓度随时间变化的情况如下图所示。
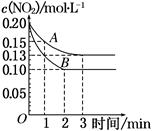
请回答:若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则曲线B此条件可能是________(填“增大压强”、 “减小压强”“升高温度”“降低温度”或“使用催化剂”)。
(3)一定温度下,在密闭容器中N2O5可发生下列反应:
①2N2O5(g)  4NO2(g)+O2(g)
4NO2(g)+O2(g)
②2NO2(g)  2NO(g)+O2(g)
2NO(g)+O2(g)
若达平衡时,c(NO2)=0.6 mol/L,c(O2)=1.3 mol/L,则反应②中NO2的转化率为________
(1) 0.1 mol/(L·min) 0.1667 < (2)升高温度 (3)71.87%
题目分析:
(1)可用化学平衡计算的“三段式”计算:
CO (g) + H2O (g)  CO2(g) + H2 (g)
CO2(g) + H2 (g)
起始浓度:1mol/L 0.5mol/L 0mol/L 0mol/L
变化浓度:0.2mol/L 0.2mol/L 0.2mol/L 0.2mol/L
平衡浓度:0.8mol/L 0.3mol/L 0.2mol/L 0.2mol/L
n(H2O)= 0.2mol/L¸2min=" 0.1" mol/(L·min)
K= (0.2mol/L´ 0.2mol/L)¸( 0.8mol/L´0.3mol/L)=0.1667
若往容器中再加入2 mol CO (g),CO (g)浓度增大,平衡右移,但H2O (g)浓度比原平衡小,CO (g)的转化率会减小。
(2)B反应过程中NO2的浓度比A小,故平衡右移,到达平衡的时间短,所以影响因素为“升高温度”。
(3) 2N2O5(g)  4NO2(g)+O2(g)
4NO2(g)+O2(g)
4x x
2NO2(g)  2NO(g)+O2(g)
2NO(g)+O2(g)
2y y
x+y=1.3 4x-2y=0.6
解:x=0.53 y=0.77
NO2的转化率为:2´0.77¸4´0.53=0.718 即71.87%
点评:掌握平衡计算的“三段式”。能分析化学平衡移动的影响因素。
