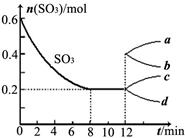
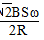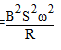(12分)在一个2L的密闭容器中,投入反应物,发生反应2SO3(g) 2SO2(g)+O2(g) ΔH>0,其中SO3的变化如下图所示:
2SO2(g)+O2(g) ΔH>0,其中SO3的变化如下图所示:
(1)写出该反应的平衡常数表达式并根据8min时到达平衡计算出结果 。
(2)用O2表示0到8min内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
A.v(SO3)=2v(O2) B.容器内压强保持不变
C.v(SO2)逆=2v(O2)正 D.容器内密度保持不变
(4)在第12min时,容器压缩到1L,则SO3的变化曲线为 。
A.a B.b C.c D.d
(5)若保持容积不变在第12min时,加入SO3(g),则平衡向 反应方向移动(填“正”或“逆”)。SO3的体积分数 (填“增大”或“减小”)。
(1)K=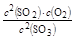 = 0.4 (2)0.0125 mol/(L·min)
= 0.4 (2)0.0125 mol/(L·min)
(3)B、C (4)C (5)正 增大
题目分析:(1)K=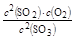 ,8分钟时c(SO3)=0.1mol/L,则c(SO2)=0.2mol/L,c(O2)=0.1mol/L,所以K=0.4。
,8分钟时c(SO3)=0.1mol/L,则c(SO2)=0.2mol/L,c(O2)=0.1mol/L,所以K=0.4。
(2)v(O2)=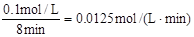
(3)反应前后压强不等,所以可以用压强不再变化判断反应达平衡,v(SO2)逆=2v(O2)正,正逆反应速率相等,可以判断反应达平衡,因此选BC。
(4)容器压缩的瞬间,SO3物质的量不变,随即平衡逆向移动,SO3的物质的量增大,所以c曲线符合。
(5)若保持容积不变在第12min时,加入SO3(g),相当于对体系加压,平衡正向移动,但SO3的体积分数增大。
点评:本题非常基础,只要掌握影响平衡移动的因素即可。

 cosωt
cosωt