(10分)在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:
C(s)+H2O(g)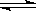 CO(g)+H2(g) , 试分析和回答下列问题:
CO(g)+H2(g) , 试分析和回答下列问题:
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是 。
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2
D.1 mol H-H键断裂的同时断裂2 mol H-O键(2)若上述化学平衡状态从正反应方向开始建立,达到平衡后,缩 * * 衡体系的体积,则容器内气体的平均摩尔质量将 (填“不变”、“变小”、“变大”)。
(3)若上述化学平衡状态从正、逆两反应方向同时建立[即起始时同时投放C(s)、H2O(g)、CO(g)、H2(g)],达到平衡后,试讨论:
① 容积内气体混合物的平均摩尔质量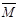 的取值范围是 。
的取值范围是 。
② 若给平衡体系加压,请参照起始投放的气体物质的平均摩尔质量(设定为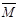 1),分别给出
1),分别给出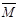 的变化:(填“增大”、“减小”、“不变”)
的变化:(填“增大”、“减小”、“不变”)
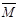 1的取值 1的取值 | 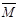 的变化 的变化 |
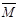 1<12 1<12 | |
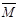 1=12 1=12 | 不变 |
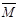 1>12 1>12 |
(1)B、D(2分) (2)变大(2分) (3)①2<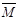 <28(2分)
<28(2分)
② 减小;(2分)增大(2分)。
题目分析:(1)达到平衡状态的标志是正反应速率等于逆反应速率,B正确,D正确。这个反应不论是否平衡,压强都不会改变。C选项中都描述的是正反应速率。(2)缩 * * 衡体积,平衡不移动,但是密度增大,平均摩尔质量变大。(3)①可以看到只有三种是气体,相对分子质量分别为H2O(18),CO(28),H2(2),混合之后,混合气体的平均相对分子质量不应该大于最大的28,也不能小于最小的2,理解方法就是极限法,假设绝大多数气体是H2,只有一点点H2O和CO,平均相对分子质量将会非常接近2。由于题目中没有给平衡常数,所以任何气体的组合都是可以的。所以答案为2<M<28。
②设反应平衡时候(加压之前)H2O为a mol,CO为b mol,H2为c mol
加压以后,平衡要向逆反应方向移动,设反应了x mol(x应该小于b,c中最小的那个)
达到新平衡后,三种物质的物质量为a+x b-x c-x 摩尔
根据平均相对分子质量的计算公式

很容易得到18a+28b+2c=M1(a+b+c)
消去18a+28b+2c,得
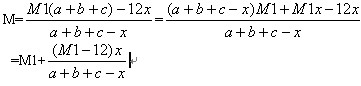
然后观察这个式子,进行讨论即可。
(1)当M1=12时,M=M1,平均相对分子质量不变
(2)当M1>12时,后面的分式为正,平均相对分子质量变大
(3)当M1<12时,后面的分式为负,平均相对分子质量变小
点评:本题采用渐进的题目难度来考查化学反应平衡原理,综合性较强,题目难度不大。
