问题
选择题
常温下,向盛有1 L 0.1 mol·L-1 NaHSO4溶液的烧杯中不断滴加0.05 mol·L-1的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如下图所示,下列说法不正确的是
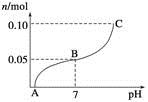
A.A点时pH=1
B.恰好完全沉淀时Ba(OH)2的体积为2 L
C.B点时,溶液中的离子浓度关系为c(Na+)>c( )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
D.C点时pH=14
答案
答案:D
0.1 mol·L-1 NaHSO4溶液中c(H+)=0.1 mol·L-1,pH=1,A正确;往NaHSO4溶液中滴加Ba(OH)2反应过程为①2NaHSO4+Ba(OH)2===BaSO4↓+Na2SO4+2H2O(中性),继续加入Ba(OH)2溶液,Na2SO4+Ba(OH)2===BaSO4↓+2NaOH,总反应为②NaHSO4+Ba(OH)2===BaSO4↓+NaOH+H2O,故恰好完全沉淀时,n(NaHSO4)=n[Ba(OH)2],由此求出Ba(OH)2体积为2 L,B正确;B点时发生反应①,溶质为Na2SO4,pH=7,C正确;C点时发生反应②,n(OH-)=1×0.1=0.1 mol,但溶液体积为3 L,
c(OH-)= ≈0.033 mol·L-1,pH≠14,D错
≈0.033 mol·L-1,pH≠14,D错

