问题
填空题
已知下列热化学方程式:
①H2(g)+ O2(g)=H2O(l)ΔH=-285.8 kJ/mol
O2(g)=H2O(l)ΔH=-285.8 kJ/mol
②H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ/mol
O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③C(s)+ O2(g)=CO(g)ΔH=-110.5 kJ/mol
O2(g)=CO(g)ΔH=-110.5 kJ/mol
④C(s)+O2(g)=CO2(g)ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是 。
(2)H2的燃烧热为 ,C的燃烧热为 。
(3)燃烧10 g H2生成液态水,放出的热量为 。
(4)CO的燃烧热为 ,其热化学方程式为 。
答案
(1)①②③④
(2)285.8 kJ/mol 393.5 kJ/mol
(3)1 429.0 kJ
(4)283.0 kJ/mol CO(g)+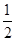 O2(g)=CO2(g) ΔH=-283.0 kJ/mol
O2(g)=CO2(g) ΔH=-283.0 kJ/mol
(1)所有燃烧均为放热反应,故①②③④均为放热反应。
(2)燃烧热为1 mol纯物质完全燃烧生成稳定氧化物时放出的热量,H2的燃烧热为285.8 kJ/mol,C的燃烧热为393.5 kJ/mol。
(3)Q放= ×285.8 kJ/mol=1 429.0 kJ。
×285.8 kJ/mol=1 429.0 kJ。
(4)由④-③可得,CO(g)+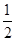 O2(g)=CO2(g)ΔH=-393.5+110.5=-283.0(kJ/mol),
O2(g)=CO2(g)ΔH=-393.5+110.5=-283.0(kJ/mol),
故CO的燃烧热为283.0 kJ/mol。
