某温度(t ℃)时,水的离子积为KW=1.0×10-13,则该温度(填“大于”、“小于”或“等于”)________25 ℃,其理由是
____________________________________________________________。
若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
(1)若所得混合液为中性,则a∶b=________;此溶液中各种离子的浓度由大到小排列顺序是___________________________________。
(2)若所得混合液的pH=2,则a∶b=________。此溶液中各种离子的浓度由大到小排列顺序是__________________________________________。
大于 水的电离是吸热过程,KW随温度升高而增大 (1)10∶1 c(Na+)>c(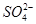 )>c(H+)=c(OH-)或c(Na+)=2c(
)>c(H+)=c(OH-)或c(Na+)=2c(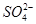 )>c(H+)=c(OH-) (2)9∶2
)>c(H+)=c(OH-) (2)9∶2
c(H+)>c(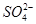 )>c(Na+)>c(OH-)
)>c(Na+)>c(OH-)
水的电离是吸热过程,KW随温度升高而增大,故温度高于25 ℃。
稀H2SO4中,c(H+)=0.1 mol·L-1,NaOH溶液中
c(OH-)=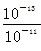 =0.01 mol·L-1
=0.01 mol·L-1
(1)0.01 mol·L-1×a L=0.1 mol·L-1×b L
a∶b=10∶1
离子浓度关系c(Na+)>c(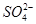 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
或c(Na+)=2c(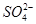 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
(2)若pH=2,则
c(H+)混==0.01 mol·L-1
a∶b=9∶2
离子浓度关系:此时,假如原来NaOH溶液为9 L,H2SO4溶液则为2 L
n(Na+)=0.01 mol·L-1×9 L=0.09 mol
剩余n(H+)=0.01 mol·L-1×(9 L+2 L)=0.11 mol
n(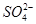 )=×2 L=0.1 mol
)=×2 L=0.1 mol
所以:c(H+)>c(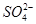 )>c(Na+)>c(OH-)。
)>c(Na+)>c(OH-)。