(6分)如下图,甲、乙、丙分别表示在不同条件下可逆反应:
A(g)+B(g) xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
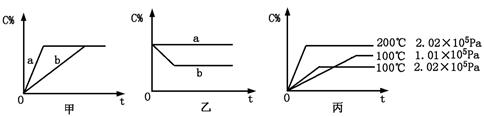
请根据图象回答下列问题:
(1)若甲图中两条曲线分别表示有催化剂和无催化剂的情况,则 曲线表示无催化剂时的情况(填字母,下同);
(2)若乙图表示反应达到平衡后分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入惰性气体后的情况,则 曲线表示恒温恒容的情况;
(3)根据丙图可以判断该可逆反应的正反应是 热反应(填“吸”或“放”),计量数x的值 (填取值范围);判断的依据分别是 。
(1)b
(2)a
(3)吸 大于2(或>2或≥3)
压强不变,升高温度,C%增大,说明平衡向正反应方向移动,故正反应为吸热反应
保持温度不变,增大压强,C%减小,说明平衡向逆反应方向移动,故x>1+1=2
题目分析:(1)加入催化剂,可以加快反应速率,缩短达到平衡所需的时间。
(2)恒温恒容下向平衡组分中充入惰性气体,体系的总压强增大,各部分的分压不变,因此反应速率增大,平衡不移动。
(3)丙图中,升高温度,生成物的百分含量增大,说明温度升高,平衡向正反应方向移动,因此正反应为吸热反应。另外从图中可以看出:增大压强,生成物的百分含量减少,说明压强增大,平衡向逆反应方向移动,,因此x的取值应大于2.
点评:本题考查了化学平衡移动的相关知识。
①加入催化剂,可以增大反应速率,但不影响化学平衡的移动。
②升高温度,平衡向吸热反应方向移动。
③增大压强,平衡向气体体积减少的方向移动。对于反应前后,气体体积不变的反应,增大压强,反应速率增大,平衡不发生移动。
④对于结合坐标图的分析,首先,应明确横坐标纵坐标所代表的量。其次,分析的时候应由点到线再到面进行分析。最后,对于多变量的分析,应采用控制变量法。
