(14分)在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的NaHSO4,测得混合溶液的部分pH如下表所示:
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的pH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | x | 7 |
| ③ | 33.00 | 33.00 | 6 |
(2)b=____________,x =" ______mL" 。
(3)反应③的离子方程式为____________________________
(4)将此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中
c(Ba2+)﹕c(OH-)= ;
(5) 与NaHSO4相同, NaHSO3和NaHCO3也为酸式盐。已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是___________(填正确答案的标号)。
A.c(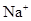 )>c(
)>c(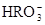 )>c(
)>c(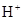 )>c(
)>c(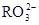 )>c(
)>c(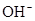 )
)
B.c(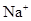 )+c(
)+c(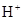 )=c(
)=c(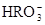 )+2c(
)+2c(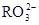 )+c(
)+c(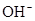 )
)
C.c(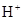 )+c(
)+c(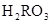 )=c(
)=c(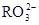 )+c(
)+c(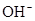 )
)
D.两溶液中c(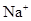 )、c(
)、c(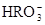 )、c(
)、c(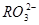 )分别相等
)分别相等
(每空2分)
(1)> , 1×10—12
(2) 4, 27
(3) Ba2+ + 2OH— + 2H+ + SO42— = BaSO4 ↓+ 2H2O
(4) 1:20
(5) ABC
题目分析:(1)t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则Kw = c(H+) ×c(OH-)=10-(a+b)=1×10-12>1×10-14,所以t>25;
(2)未加入硫酸氢钠溶液的Ba(OH)2的稀溶液pH=8,说明Ba(OH)2的稀溶液中c(H+)=10-8 mol/L,则a=8,b=4;33mL的Ba(OH)2的稀溶液加入xmL的pH=4的NaHSO4后pH=7,说明此时溶液显碱性,则c(OH-)×V(Ba(OH)2)- c(H+)×x=1×10-12/1×10-7×(x+33),解得x=27;
(3)反应③是等体积的Ba(OH)2溶液与NaHSO4溶液反应,混合后溶液呈中性,所以离子方程式为Ba2+ + 2OH— + 2H+ + SO42— = BaSO4 ↓+ 2H2O
(4)Ba(OH)2是强碱,1mL的Ba(OH)2溶液中c(Ba2+)="0.5" c(OH-)=1/2×10-4mol/L,稀释1000倍后,c(Ba2+)=5×10-8mol/L,c(OH-)=1×10-7mol/L< c(H+),碱溶液中不可能存在c(OH-) < c(H+),所以此时稀释后的溶液中氢氧根离子浓度按纯水计算,c(OH-)=1×10-6mol/L,则c(Ba2+)﹕c(OH-)= 5×10-8mol/L/1×10-6mol/L=1:20;
(5)NaHSO3溶液呈酸性,说明HSO3-的电离程度大于其水解程度;NaHCO3溶液呈碱性,说明HCO3-的水解程度大于其电离程度。A、若R是S元素,则c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-),正确;B、无论R是哪种元素,都符合电荷守恒规律,正确;C、无论R是哪种元素,都符合物料守恒规律,c(Na+)=c(HRO3-)+c(RO32-)+c(H2RO3),与c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-)相结合,即得
c(H+)+c(H2RO3)=c(RO32-)+c(OH-),正确;D、两溶液中c(Na+)相等,NaHSO3溶液c(RO32-)较大,但c(HRO3-)无法判断,错误,凳矮矮选ABC。
