问题
计算题
在一定温度下,10L密闭容器中加入5.0molSO2、4.5molO2,发生反应:2SO2 + O2 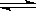 2SO3经10min后反应达平衡时O2的浓度为0.30mol/L。请计算(写出计算过程):
2SO3经10min后反应达平衡时O2的浓度为0.30mol/L。请计算(写出计算过程):
(1)10min内SO2的转化率;
(2)平衡常数K。
答案
(1)60% (2)7.5L/mol
题目分析:10L密闭容器在10min内各物质浓度发生的变化如下:
2SO2 + O2  2SO3
2SO3
起始浓度(mol/L)0.50 0.45 0
变化浓度(mol/L)0.30 0.15 0.30
平衡浓度(mol/L)0.20 0.30 0.30
则:(1)10min内SO2的转化率为: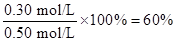
(2)平衡常数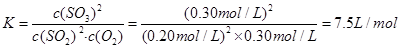
点评:对于化学平衡的相关计算,应利用“三段式法”,可以起到事半功倍的效果。另外应掌握化学平衡常数只与温度有关,温度不变,平衡常数的值不变。
