(6分)在容积为10L的密闭容器中,通入40molN2和120molH2,在一定条件下进行反应,2s后达到平衡状态,此时N2的浓度是2mol/L,试求:
(1)用H2的浓度变化表示的2s内的平均反应速率为多少?
(2)N2的转化率为多少?
(3)平衡时NH3的体积分数为多少?(要求有计算过程)
解: (1)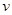 (
(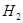 )="3mol" •L-1 •s-1
)="3mol" •L-1 •s-1
(2)N2的转化率="50%"
(3) NH3的体积分数=33.3%
题目分析:本题是关于可逆反应中的计算题,利用“三段法”来对反应中三个状态时的各物质的浓度进行分析,从而来进行计算。由题意已知了N2的初始浓度,而在反应2S后达到平衡状态,此时N2的浓度是2mol/L,根据N2浓度的变化即可进行计算。根据化学反应中计量数之比等于化学反应速率之比可以用其它物质来对化学反应速率进行描述。
解题过程如下:
2秒后N2的物质的量为2mol/L×10L=20mol
N2 + 3H2 = 2NH3
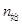 40 120 0
40 120 0
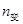 20 60 40
20 60 40
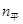 20 60 40
20 60 40
(1)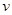 (
(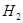 )=
)=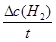 =
=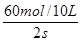 ="3mol" •L-1 •s-1
="3mol" •L-1 •s-1
(2)N2的转化率:N2%=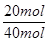 ×100%=50%
×100%=50%
(3) NH3的体积分数:NH3%=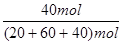 =33.3%
=33.3%
点评:本题属于平衡计算题目,常用的方法就是三段式的解法,可以清晰的判断各个过程中物质的量的变化,并进行计算,属于常规解题方法。
