某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度。下表是4种常见指示剂的变色范围:
| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(1)该实验应选用 作指示剂。
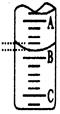
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL;反应达滴定终点时的现象为 。
(3)为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积;
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液;
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗;
D.锥形瓶预先用食用白醋润洗过;
E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不用化简):C1= mol/L。
(1)酚酞,(2)25.40; 当滴入最后一滴溶液从无色突变为粉红色,且在半分钟内不褪色;
(3)BD (4)[(25.35+25.30)/2]×C/V
题目分析:(1)由于酸碱恰好完全中和时产生的盐是强碱弱酸盐,水溶液显碱性,所以应该选择在碱性范围内变色的指示剂酚酞作该反应的水解指示剂。(2)A为25.00ml,A——C之间有10个格,相差1ml.。所以根据图示可知滴定管中液面读数应为25.40ml.。由于是用已知浓度的碱滴定未知浓度的酸,指示剂在酸溶液中,所以溶液开始为无色,当达到滴定终点时,溶液由无色变为浅红色,半分钟内不变色。(3)由实验数据可以看出第一组数据偏差较大,应该舍去。可能的原因是:A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积;则体积偏小。错误。B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液;则由于开始时读数偏小,使得滴定消耗的碱标准溶液体积偏大。正确。C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗;则锥形瓶中的待测溶液的物质的量偏少,滴定达到终点时消耗的标准溶液体积偏低。错误。D.锥形瓶预先用食用白醋润洗过;由于酸增大导致消耗的碱标准溶液体积偏大。正确。E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。可能局部中和而消耗的碱标准溶液体积偏小。错误。因此。选项为B、D。(4)酸碱恰好完全中和时的物质的量相等。由于第一次数据偏差大,舍去,V(碱)=(25.35+25.30)/2ml.;由于C(碱)·V(碱)=C(酸)·V(酸)。所以C(酸)="{" C(碱)·V(碱)}÷V(酸)= [(25.35+25.30)/2ml×cmol/L]÷Vml=[(25.35+25.30)/2]×C/V.
