已知A(g)+B(g)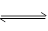 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| |温度/ ℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个2 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.005 mol·L-1·s-1。,则6s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变 b.c(A)不随时间改变
c.气体的密度不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)1000℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
(10分)
(1)K= 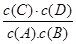 (1分) <(1分)
(1分) <(1分)
(2) 0.07(2分) 0.06(2分) 80% (2分)
(3) b(1分)
(4) 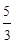 (1分)
(1分)
题目分析:(1)根据平衡常数的概念即可得出K=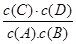 ,温度升高,平衡常数减小,即反应逆向进行,为吸热反应,正向反应为放热反应,△H<0;
,温度升高,平衡常数减小,即反应逆向进行,为吸热反应,正向反应为放热反应,△H<0;
(2) v(A)=0.005 mol·L-1·s-1="△c(A)/" 6s解得△c(A)="0.03" mol·L-1,则6s时c(A)="0.1-0.03=0.07" mol·L-1;C的浓度为0.03 mol·L-1,体积为2L,则C的物质的量为0.06mol;设反应的A的物质的量为xmol,830℃时,平衡常数为1.0,列出方程式x2/(0.2-x)(0.8-x)=1.0可解得x=0.06mol,则A的转化率为0.16/0.2·100%=80%。
(3) a.该反应过程气态物质体积不变,压强不随时间改变,不能作为判断该反应是否达到平衡的依据b.c(A)不随时间改变,说明已经达到平衡;c.该过程气体的密度不随时间改变,同理不能判断;d.整个过程,单位时间里生成C和D的物质的量相等,也不能作为判断的依据。故选b。
(4)该反应的平衡常数值为A(g)+B(g)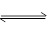 C(g)+D(g)反应的平衡常数的倒数,即1/0.6=
C(g)+D(g)反应的平衡常数的倒数,即1/0.6=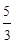 。
。
点评:本题考查化学平衡的判断和平衡常数的概念,难度不大。
