在一定温度下,冰醋酸(即纯醋酸)加水稀释过程中,溶液的导电能力如下图所示,则:
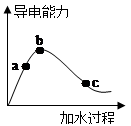
⑴“O”点导电能力为0的理由是____________________________________。
⑵用湿润的pH试纸测量a处溶液的pH,测量结果_________(偏大、偏小或不变)
⑶比较a、b、c三点的下列数据大小或等量关系:(如a>b>c、c=a>b、a=b=c等)
①pH:__________;
②醋酸的电离度:_________;
③醋酸的电离平衡常数:__________;
④a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:___________。
⑷若使c点溶液中c(CH3COO―)增大,c(H+)减小,可采用的措施有(答二类不同的物质):
①___________________②_____________________。
⑸在稀释过程中,随着c(CH3COOH)的降低,下列始终保持增大趋势的量是( )
A.c(H+)
B.H+个数
C.CH3COOH个数
D.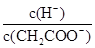
⑴冰醋酸未电离,无自由移动的离子。(2分) ⑵偏小(2分)
⑶①c>a>b;(2分)②c>b>a;(2分)③a=b=c(2分)④;(2分)
⑷①加NaOH;(1分)②加Na2CO3等固体(1分) ⑸BD(2分)(共16分)
题目分析:(1)“O”点冰醋酸未电离,无自由移动的离子,所以“O”点溶液导电能力为0。
(2)醋酸是弱酸,稀释促进电离,则用湿润的pH试纸测量a处溶液的pH,根据图像可知,测量结果偏小。
(3)①溶液中氢离子浓度越大,溶液的导电能力越强,则pH大小顺序是c>a>b。
②稀释促进电离,则醋酸的电离度大小顺序是c>b>a。
③醋酸的电离平衡常数只与温度有关系,因此电离平衡常数相等,即a=b=c。
a、b、c三点溶液中醋酸的物质的量是相等,则消耗氢氧化钠的物质的量是相等的,即a=b=c。
(4)根据外界条件对电离平衡对影响可知,要使c点溶液中c(CH3COO―)增大,c(H+)减小,可采用的措施是加NaOH或加Na2CO3等固体。
(5)稀释促进电离,CH3COOH个数、氢离子的浓度减小,但氢离子的个数是增加的,所以始终保持增大趋势的是B和D。
点评:该题是高考中的常见题型,属于基础性试题的考查,试题难易适中,侧重对学生基础知识的巩固与训练,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。
