(1)(4分)高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+CO(g)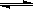 2/3Fe (s)+CO2(g),已知该反应在不同温度下的平衡常数如下。则:
2/3Fe (s)+CO2(g),已知该反应在不同温度下的平衡常数如下。则:

①该反应的△H_____0(填“>”、“<”或“=”);
②在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求CO的平衡转化率= ________。
(2)(3分)常温下,HR(酸)溶液pH=3,MOH(碱)的溶液pH=11,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式
___________________________________________。
(3)(3分)25℃时,pH=0的HCl、0.1mol/L的HCl、0.01mol/L的NaOH、pH=14的NaOH四种溶液中由水电离产生的c(H+)之比为 。
(4)(3分)已知25℃时,电离常数Ka(HF)=3.6×10-4,则0.1 mol·L-1 HF溶液中c(H+)= mol·L-1。
(16分)
(1)(4分)< 60%
(2)(3分)M++H2O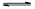 MOH+H+
MOH+H+
(3)(3分)1:10:100:1
(4)(3分)6×10-3
(5)(3分)7
题目分析::(1)①由表中数据可知,温度越高平衡常数越小,故升高温度平衡向逆反应移动,正反应为放热反应,即△H<0。②令平衡时CO的物质的量变化为nmol,则:
1/3Fe2O3(s)+CO(g)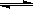 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
开始(mol):1 1
变化(mol):n n
平衡(mol):1-n 1+n
所以(1+n)/(1-n) =4,解得n=0.6,
所以n(CO)=0.6mol÷1mol×100%=60%。
(2)依据盐类的规律“谁弱谁水解,谁强显谁性”,MR是弱酸强碱盐,故水解反应的离子方程式为M++H2O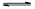 MOH+H+。
MOH+H+。
(3)四种溶液中由水电离产生的c(H+)分别为:10-14、10-13、10-12、10-14,之比为1:10:100:1。
(4)电离常数Ka(HF)=c(H+)×c(F-)÷c(HF) =3.6×10-4,c(HF)=" 0.1" mol·L-1,c(H+)=c(F-),故c(H+)=6×10-3。
(5)(3分)在温度t ℃时,pH=3的某水溶液中c(OH-)=10-8 mol/L。在此温度下5×10—5mol/LBa(OH)2溶液的pH= 。
(5)在温度t ℃时,离子积常数K= c(OH-)×c(H+)=10-3 (mol/L)×10-8 (mol/L) =10-11 (mol/L)2。5×10—5mol/LBa(OH)2溶液中,c(OH-)=10-4 mol/L,根据K= c(OH-)×c(H+),得c(H+)= 10-7 mol/L,pH=7。
点评:本题考查的是综合的知识,题目难度中,注意基础知识的学习、掌握及应用。
