问题
选择题
某温度下,对于反应N2(g)+3H2(g)  2NH3(g) ;△H=-92.4kJ/mol。
2NH3(g) ;△H=-92.4kJ/mol。
N2的平衡转化率(α)与体系总压强(P)的关系如右图所示。下列说法正确的是:
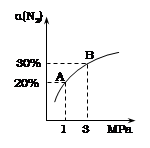
A. 将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ
B. 平衡状态由A变到B时,平衡常数K(A) < K(B)
C. 上述反应在达到平衡后,增大压强,H2的转化率提高
D. 保持压强不变,通入惰性气体,平衡常数不变,平衡不移动
答案
答案:C
题目分析:该反应是可逆反应,转化率达不到100%,所以A中实际放出的热量小于92.4kJ,A错误;平衡状态由A变到B时,温度不变,则平衡常数K(A)=K(B),选项B错误;正方应是体积减小的,则增大压强平衡向正反应方向移动,所以氢气的转化率增大,C正确;保持压强不变,通入惰性气体,则容器的容积必然增大,平衡常数不变,但平衡向逆反应方向移动,D不正确,答案选C。
点评:该题是高考中的常见题型和重要考点,属于中等难度试题的考查。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养和方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力。该题需要特别注意压强对反应速率以及平衡状态影响的实质是通过改变物质的浓度引起的,所以在分析压强的变化时,应该分析物质的浓度是否发生了变化。
