问题
填空题
工业上通过氮气和氢气反应合成氨,氨经一系列反应可以得到硝酸。反应如下图所示
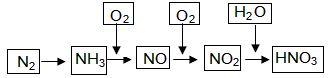
请回答:
(1)NO2与H2O反应中的还原剂是___________。
(2)NH3与O2制取NO的化学反应方程式___________。
(3)下列说法不正确的是(选填序号字母)___________。
a.氨可用作制冷剂
b.铵态氮肥一般不能与碱性化肥共同使用
c.硝酸可用于制化肥、农药、炸药、染料、盐类等
d.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1mol NO2
(4)大量排放含N、P化合物的废水,会导致水体污染。其中含氮的物质主要是蛋白质,蛋白质在水中分解会产生氨气,氨气在微生物的作用下与氧气反应生成HNO2,上述氨气与氧气的反应中,氧化剂与还原剂的物质的量之比为___________。
(5)已知
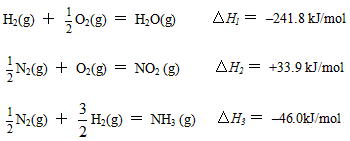
则17g氨气与氧气反应生成NO2(g)与H2O(g)时,△H=___________kJ/mol。
(6)氨气是氮肥工业的重要原料,某化肥厂生产铵态氮肥(NH4)2SO4的工艺流程如下
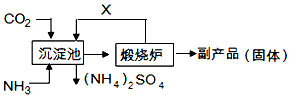
向装有CaSO4悬浊液的沉淀池中先通氨气,再通CO2的原因是___________。
答案
(1)NO2
(2)4NH3 + 5O2 = 4NO + 6H2O
(3)d
(4)3:2
(5)-282.8
(6)氨在水中的溶解度大,使溶液呈碱性,有利于吸收CO2,增大c(CO32-),促使CaSO4转化为
CaCO3,同时生成(NH4)2SO4。
