(1)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 ;加入石膏(CaSO4 2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
(2)在一定条件下进行如下反应:aX(g)+bY(g) cZ(g)
cZ(g)
右图是不同温度下反应达到平衡时,反应混合物中Z的体积分数 和压强关系示意图。
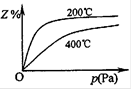
① 写出该反应的化学平衡常数表达式:K= 。随着温 度的升高,K值 (填“增大”、“减小”或“不变”)。当反应物起始浓度相同时,平衡常数K值越大,表明 (字母填序号)。
A.X的转化率越高
B.反应进行得越完全
C.达到平衡时X的浓度越大
D.化学反应速率越快② 如右图所示,相同温度下,在甲、乙两容器中各投入1molX、2molY和适量催化剂,甲乙两容器的初始体积均为1L,甲、乙容器达到平衡所用时间:甲 乙(填“>”、“<”或“=”,下同),平衡时X和Y的转化率:甲 乙。
(1)CO32-+H2O HCO3-+OH― HCO3-+H2O
HCO3-+OH― HCO3-+H2O H2CO3+OH―
H2CO3+OH―
CaSO4 2H2O+Na2CO3=CaCO3↓+Na2SO4+2H2O
2H2O+Na2CO3=CaCO3↓+Na2SO4+2H2O
(2)①  减少 AB
减少 AB
② > <
题目分析:(1)土壤呈碱性的原因是由于CO32-和HCO3的水解产生了OH―,其离子方程式为:
CO32-+H2O HCO3-+OH―和 HCO3-+H2O
HCO3-+OH―和 HCO3-+H2O H2CO3+OH―;加入石膏(CaSO4
H2CO3+OH―;加入石膏(CaSO4 2H2O),Ca2+可以跟CO32-生成溶解度很小的CaCO3,促进上述平衡向坐移动,从而使土壤碱性降低,有关反应的化学方程式为:CaSO4
2H2O),Ca2+可以跟CO32-生成溶解度很小的CaCO3,促进上述平衡向坐移动,从而使土壤碱性降低,有关反应的化学方程式为:CaSO4 2H2O+Na2CO3=CaCO3↓+Na2SO4+2H2O ;(2)①对于aX(g)+bY(g)
2H2O+Na2CO3=CaCO3↓+Na2SO4+2H2O ;(2)①对于aX(g)+bY(g) cZ(g),其化学平衡常数表达式:K=
cZ(g),其化学平衡常数表达式:K= ,由图可以看出该反应是放热反应,所以温度升高,K值减少;当反应物起始浓度相同时,平衡常数K值越大,说明反应进行得越完全,同时X或者是Y的转化率越高,故选AB;②由反应混合物中Z的体积分数和压强关系示意图还可以看出,a+b>c,当甲乙两容器的初始体积均为1L时,由于甲是固定体积,乙的体积可变化,又a+b>c,所以乙的反应速率大,达到平衡的时间短,所以所用时间:甲>乙,同样又由于a+b>c,甲的转化率<乙。
,由图可以看出该反应是放热反应,所以温度升高,K值减少;当反应物起始浓度相同时,平衡常数K值越大,说明反应进行得越完全,同时X或者是Y的转化率越高,故选AB;②由反应混合物中Z的体积分数和压强关系示意图还可以看出,a+b>c,当甲乙两容器的初始体积均为1L时,由于甲是固定体积,乙的体积可变化,又a+b>c,所以乙的反应速率大,达到平衡的时间短,所以所用时间:甲>乙,同样又由于a+b>c,甲的转化率<乙。
点评::该题考查化学平衡的移动,是高考的考查重点,该题的信息量较大,但是难度不大。
