问题
选择题
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)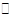 4NO2 +O2(g)△H>0,T1温度下的部分实验数据为:
4NO2 +O2(g)△H>0,T1温度下的部分实验数据为:
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol/L | 5.00 | 3.55 | 2.50 | 2.50 |
下列说法中,正确的是:
A.当反应体系内气体的平均相对分子质量不再发生变化时则该反应达到了平衡
B.T1温度下的平衡常数为K1=125,500s时N2O5的转化率为71%:
C.其他条件不变时,T2温度下反应到2000s时测得N2O5 (g)浓度为2.78mol/L, 则T1<T2
D.T1温度下的平衡常数为K1,若维持T1温度不变,增加体系压强,达到新的平衡时,平衡常数为K2,则K2>K1
答案
答案:A
题目分析: 2N2O5(g)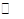 4NO2 +O2(g)△H>0
4NO2 +O2(g)△H>0
C始(mol/L) 5.00 0 0
C改变(mol/L) 2.50 5.0 2.5
C末(mol/L) 2.50 5.0 2.5
B.T1温度下的平衡常数为K1= =250,500s时N2O5的转化率为
=250,500s时N2O5的转化率为 =29%:C.其他条件不变时,T2温度下反应到2000s时测得N2O5 (g)浓度为2.78mol/L,根据勒夏特列原理,应该采用了降温措施, T1>T2;D.化学平衡常数只跟温度有关,温度不变,化学平衡常数不变。
=29%:C.其他条件不变时,T2温度下反应到2000s时测得N2O5 (g)浓度为2.78mol/L,根据勒夏特列原理,应该采用了降温措施, T1>T2;D.化学平衡常数只跟温度有关,温度不变,化学平衡常数不变。
