问题
填空题
在一密闭的2 L容器中装有4 mol SO2和2 mol O2,在一定条件下开始反应。2 min末测得容器中有1.6 mol SO2,请计算:(1)2 min末SO3的浓度 ;(2)2 min内SO2的平均反应速率 (3)2 min末SO2与O2的压强的比 。
答案
(第(1)题3分,其余每空2分)1.2 mol/L; 0.6 mol/(L·min);2:1
题目分析:该反应的化学方程式是
2SO2 + O2 2SO3
2SO3
起始浓度(mol/L) 2 1 0
转化浓度(mol/L) 1.2 0.6 1.2
2min末浓度(mol/L) 0.8 0.4 1.2
所以2 min末SO3的浓度是1.2mol/L
2 min内SO2的平均反应速率是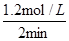 =0.6 mol/(L·min)
=0.6 mol/(L·min)
在温度和体积相同的条件下,气体的压强之比是物质的量之比
所以2 min末SO2与O2的压强的比1.2:0.6=2:1
点评:在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某时刻的量,然后依据已知条件列式计算即可,有利于培养学生的规范答题能力。
