铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) △H=akJ·mol-1
3AlCl(g)=2Al(l)+AlCl3(g) △H=bkJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=______kJ·mol-1(用含a、b的代数式表示)。
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为__________________________。
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为
Mg17Al12+17H2=17MgH2+12Al。得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是_____________________。
②在6.0mol·L-1HCl溶液中,混合物Y能完全释放出H2。1molMg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为__________。
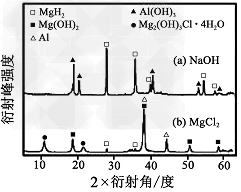
③在0.5mol·L-1NaOH和1.0mol·L-1MgCl2溶液中,下图混合物Y均只能部分放出氢气,反应后残留固体物质的X-射线衍射谱图如图所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH溶液中,混合物Y中产生氢气的主要物质是______________ (填化学式)。
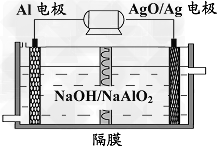
(3)铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为_________________。
(1)①a+b;②Al4C3+12HCl=4AlCl3+3CH4↑
(2)②防止Mg、Al被空气氧化;②52mol;③Al
(3)2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O
