煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。已知:
CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
试回答下列问题
(1)上述正向反应是 反应 (填“放热”或“吸热”)
(2)要使上述反应的逆反应速率增大且平衡正反应方向移动,下列措施不可行的有
A、加入催化剂 B、增大CO的物质的量以提高体系的压强
C、降低温度 D、减小H2的浓度
(3)向某密闭容器中充入2molCO和4molH2O(g),发生反应:CO(g)+H2O(g) H2(g)+CO2(g),当反应达平衡时,CO的体积分数为X,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数不等于X的有
H2(g)+CO2(g),当反应达平衡时,CO的体积分数为X,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数不等于X的有
A、1molCO(g)+4molH2O+2molCO2(g)+2molH2(g) B、2molCO(g)+2molH2O+2molCO2(g)+2molH2(g)
C、1molCO(g)+3molH2O+0.8molCO2(g)+0.8molH2(g) D、1molCO(g)+3molH2O+1molCO2(g)+1molH2(g)
(4)若反应在800℃时进行,设起始CO和H2O(g)共为5mol,水蒸气的体积分数为X;平衡时CO的转化率为y,则y随x变化的函数关系式为y=
(5)在VL密闭容器中通入10mol CO和10mol水蒸气,在T℃达到平衡,然后急速通过碱石灰,将所得混合气体燃烧,测得放出的热量为2845KJ(已知CO燃烧热为283KJ/mol,H2燃烧热为286KJ/mol),则T℃平衡常数K= ,T= K(0℃时T=273K)
(10分)(每空2分)(1)放热(2)ACD(3)BC(4)x(5)1 1073
题目分析:(1)由表可知,温度越高,平衡常数越小,反应进行程度越小,平衡向逆反应移动,升高温度平衡向吸热方向移动,故正反应为放热反应;(2)A.加入催化剂只改变反应速率不改变化学平衡,错误;B.增大CO的物质的量以提高体系的压强,CO(g)+H2O(g)⇌H2(g)+CO2(g)反应是气体物质的量不变的反应,增大一氧化碳物质的量平衡正向进行,容器内气体物质的量增大,压强增大,正确;C.反应是放热反应,降温,速率减 * * 衡正向进行,错误;D.减小氢气浓度,平衡正向进行,但速率减小,错误.(3)向某密闭容器中充入2molCO和4molH2O(g),CO(g)+H2O(g)⇌H2(g)+CO2(g),当反应达平衡时,CO的体积分数为X;A.采用极限分析法,1molCO(g)+4molH2O+2molCO2(g)+2molH2(g),假如反应完全转化为CO和H2O物质的量为:3mol:6mol=1:2,反应前后气体体积不变,平衡相同,CO的体积分数为x,不符合;B.采用极限分析法,2molCO(g)+2molH2O+2molCO2(g)+2molH2(g),假如反应完全转化为CO和H2O物质的量为:3mol:3mol=1:1,反应前后气体体积不变,平衡正向进行,CO的体积分数大于x,符合;C.采用极限分析法,1molCO(g)+3molH2O+0.8molCO2(g)+0.8molH2(g),假如反应完全转化为CO和H2O物质的量为:1.8mol:3.8mol=9:19,反应前后气体体积不变,平衡正向进行,CO的体积分数小于x,符合;D.采用极限分析法,1molCO(g)+3molH2O+1molCO2(g)+1molH2(g),假如反应完全转化为CO和H2O物质的量为2mol:4mol=1:2,当反应达到平衡时,CO的体积分数为x.不符合.
(4)因800℃时反应平衡常数为1.
CO(g)+ H2O(g)⇌ H2(g)+ CO2(g),
起始:5(1-x) 5x 0 0
转化:5(1-x)y 5(1-x)y 5(1-x)y 5(1-x)y
平衡:5(1-x)(1-y)5(x-y+xy) 5(1-x)y 5(1-x)y
所以平衡常数k=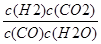 =
=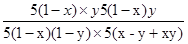 =1,解得y=x;(5)由方程式CO(g)+H2O(g)⇌H2(g)+CO2(g)可知,有1molCO反应则生成1molH2,开始通入10molCO,所以平衡时,CO、H2的物质的量共为10mol.则平均燃烧热为=284.5kJ/mol,利用平均值法计算CO、H2的物质的量之比,设CO、H2物质的量为x、y;x+y=10 283x+286y=2845 计算得到x=y=5mol;
=1,解得y=x;(5)由方程式CO(g)+H2O(g)⇌H2(g)+CO2(g)可知,有1molCO反应则生成1molH2,开始通入10molCO,所以平衡时,CO、H2的物质的量共为10mol.则平均燃烧热为=284.5kJ/mol,利用平均值法计算CO、H2的物质的量之比,设CO、H2物质的量为x、y;x+y=10 283x+286y=2845 计算得到x=y=5mol;
利用三段式法求出平衡时各组分的物质的量,
CO(g)+H2O(g)⇌H2(g)+CO2(g),
起始:10mol 10mol 0 0
转化:5mol 5 mol 5mol 5mol
平衡:5mol 5mol 5mol 5mol
所以常数平衡常数为K=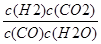 =1;图表分析可知温度为800°C,T=273+800=1073K.
=1;图表分析可知温度为800°C,T=273+800=1073K.
