(1)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知:N≡N键的键能是948.9kJ•mol-1,H-H键的键能是436.0kJ•mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量.N-H键的键能是______.
(2)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下 * * 个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ•mol-1
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.2kJ•mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ•mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:______.
(1)N2和H2合成NH3的方程式为:N2+3H2
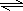
2NH3,由N2和H2合成1molNH3时可放出46.2kJ的热量,则生成2mol放出的热量为2×46.2kJ=92.4kJ,
1molN2和3molH2反应断裂化学键需要吸收的能量为:1mol×948.9kJ•mol-1+3×436.0kJ•mol-1=2256.9kJ,
N-H键的键能为x,形成2molNH3需要形成6molN-H键,则形成6molN-H键放出的能量为6x,
则6mol×x-2256.9kJ=92.4kJ,
x=391.6kJ/mol,
故答案为:391.6kJ/mol;
(2)已知:①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ•mol-1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.2kJ•mol-1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ•mol-1
CO气体还原FeO固体得到Fe固体和CO2气体的方程式为:CO+FeO=CO2+Fe,
则利用盖斯定律,将
,3×①-②-2×③ 6
可得:CO(g)+FeO(s)=CO2(g)+Fe(s);
△H=
=-218.0kJ/mol,3×(-24.8kJ/mol)-(-47.2kJ/mol)-2×(+640.5kJ/mol) 6
所以,该反应的热化学方程式为:CO(g)+FeO(s)=CO2(g)+Fe(s);△H=-218.0kJ/mol.
故答案为:CO(g)+FeO(s)=CO2(g)+Fe(s);△H=-218.0kJ/mol.
