问题
计算题
恒温条件下,将2.0molSO2与amolO2混合通入一密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g)。反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol。
2SO3(g)。反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol。
求:⑴a的值。
⑵平衡时SO2的转化率。
答案
(1)3.65mol (2)65%
题目分析:(1) 2SO2(g)+O2(g)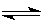 2SO3(g)
2SO3(g)
起始量(mol) 2.0 a 0
变化量(mol) 1.3 0.65 1.3
平衡量(mol) 0.7 3.0 1.3
则a=3.0mol+0.65mol=3.65mol
(2)平衡时SO3的转化率=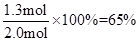
点评:在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某深刻的量,然后依据已知条件列式计算即可。
