T℃时,A、B、C三种气体在反应过程中的浓度变化如图1所示,若保持其它条件不变,温度分别为T1℃和T2℃时,B的浓度变化与时间的关系示意图如图2所示。
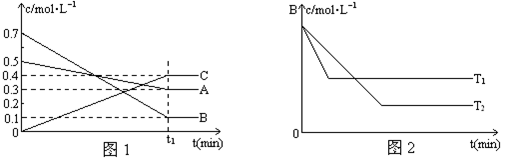
请回答下列问题:
(1)该反应的化学反应方程式是:
(2)比较大小:
A和B的转化率A B,原因是
温度的高低T1 T2,判断依据是
(3)若其它条件不变,反应进行到(t1+10)min时,A的浓度为
(6分)每空1分 (1)A(g) + 3B(g) 2C(g) (不写(g)不扣分)
2C(g) (不写(g)不扣分)
(2)小于(或<) 加入的A、B浓度比(5:7或1:1.4)大于参加反应的A、B浓度比(1:3)(其它答案合理均可得分)
高于(或>) 从图2判断,T1时,达到平衡的时间短,说明反应速率快,所以温度高(其它答案合理均可得分)
(3)0.3mol·L—1
题目分析:(1)由图(Ⅰ)可知,A和B的物质的量浓度减小,C的物质的量浓度增加,则A、B为反应物,C为生成物,由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.2mol/L:0.6mol/L:0.4mol/L=1:3:2,则反应的化学方程式为A+3B 2C。
2C。
(2)由于加入的A、B浓度比(5:7或1:1.4)大于参加反应的A、B浓度比(1:3),即相当于是增加A的浓度,平衡向正反应方向移动,所以提高B的转化率,即A的转化率低于B的转化率。从图2判断,T1时,达到平衡的时间短,说明反应速率快,所以温度高,因此稳定是T1>T2。
(3)根据图像可知,反应进行到T1时反应就已经达到平衡状态,所以若其它条件不变,反应进行到(t1+10)min时,A的浓度为不变,仍然是0.3mol/L。
点评:该题是高考中的常见题型,属于中等难度的试题。解答该题时注意分析图象的曲线变化特点,由图象得出反应的化学方程式为解答该题的关键。难点是A和B转化率的定性分析,另外A和B转化率的判断,也可以通过定量计算进行判断。
