(I)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O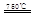 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg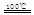 HgBr2+H2
HgBr2+H2
③HgBr2+_____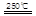 _____ + ④2HgO
_____ + ④2HgO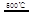 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:________ _。
根据“绿色化学”的思想评估该方法制H2的主要缺点:________ __。
(II)氢气常用生产水煤气的方法制得。CO(g)+H2O(g) CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K______1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3.0molH2O、1.0molCO2和x mol H2,则:
①当x = 5.0时,上述平衡向___________(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是__________。
(3)在850℃时,若x="5.0" mol,其它物质的投料不变,当上述反应达到平衡后,求H2的体积分数(计算结果保留两位有效数字)。
(16分)
(I)HgBr2+CaO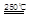 HgO+CaBr2(3分)
HgO+CaBr2(3分)
循环过程需要很高的能量,且使用重金属汞,会产生污染(3分)
(II)(1)小于(2分) (2) ①逆反应 (1分) ② 0≤x<3 (2分)
(3)解:设到达平衡时,H2或CO2减少amol,则CO、H2O增加amol,则:
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
初始物质的量/mol 1.0 3.0 1.0 5.0
变化物质的量/mol a a a a
平衡物质的量/mol 1.0+a 3.0+a 1.0-a 5.0-a (2分)
K=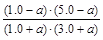 =1,解得a=0.20 (1分)
=1,解得a=0.20 (1分)
平衡时H2的体积分数= ×100% = 48% (2分)
×100% = 48% (2分)
题目分析:(I)依题意,①的生成物是②的反应物,②的生成物是③的反应物,③的生成物是④的反应物,④的反应物是HgO,则③的生成物是HgO,根据质量守恒定律可知,③的另一种反应物和生成物分别是CaO、CaBr2;(①+②+③)×2+④可得:2H2O=2H2↑+O2↑;上述4个反应都需要加热,因此消耗很多的能量才能循环制氢;上述过程中使用Hg、可溶性汞盐,它们属于重金属或重金属盐,则制氢过程能产生污染;II.(1)△H<0,说明正反应是放热反应;其它条件不变时,升高温度平衡向吸热反应方向移动,即850℃变为950℃时,平衡向逆反应方向移动,平衡常数减小,则K<1;(2)①依题意,起始时,生成物浓度幂之积与反应物浓度幂之积的比值为(1.0×5.0)/(1.0×3.0)=5/3,大于该温度下的平衡常数,说明起始时反应从逆反应方向开始进行,使生成物浓度减小、反应物浓度增大,当生成物浓度幂之积与反应物浓度幂之积的比值为1时,达到850℃时的化学平衡;②若起始时,生成物浓度幂之积与反应物浓度幂之积的比值小于1,即(1.0×x)/(1.0×3.0)<1,则0≤x<3.0;(3)设到达平衡时,H2或CO2减少amol,则CO、H2O增加amol,则:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
初始物质的量/mol 1.0 3.0 1.0 5.0
变化物质的量/mol a a a a
平衡物质的量/mol 1.0+a 3.0+a 1.0-a 5.0-a
K=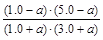 =1,解得a=0.20
=1,解得a=0.20
平衡时H2的体积分数= ×100% = 48%。
×100% = 48%。
