工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法。该法的工艺流程为CrO42- Cr2O72-
Cr2O72-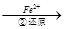 Cr3+
Cr3+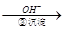 Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42- (黄色)+2H+ Cr2O72- (橙色)+H2O
Cr2O72- (橙色)+H2O
(1)若平衡体系的pH=2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是__________。
a.Cr2O72-和CrO42-的浓度相同
b.2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(3)第②步中,还原1 mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
方法2:电解法。该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为__________________。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)_________________________________。溶液中同时生成的沉淀还有__________。
(11分)(1)橙 (1分)(2)c (1分) (3)6 (2分)(4)5 (2分)
(5)阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+ 2分 (6)2H++2e-=H2↑ ,Fe(OH)3 (3分)
题目分析:(1)若平衡体系的pH=2,这说明溶液显酸性,氢离子浓度增大,因此平衡正反应方向移动,所以该溶液显橙色。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。平衡时各种物质的浓度不再发生变化,但各种物质的浓度之间不一定满足某种关系,a不能说明;速率之比是相应的化学计量数之比,因此b中的关系始终是成立,不能说明,b不正确;颜色的深浅和浓度有关系,因此当溶液有色不再发生变化时,可以说明反应达到平衡状态,c正确,答案选c。
(3)在反应②中Cr元素的化合价从+6价降低到+3价,得到3个电子。铁元素的化合价从+2价升高到+3价,上去1个电子,则根据电子得失守恒可知n(Cr2O72-)×6=n(FeSO4•7H2O)×1,解得n(FeSO4•7H2O)=6mol。
(4)根据溶度积常数的表达式Ksp=c(Cr3+)·c3(OH—)=10-32可知,当溶液中c(Cr3+)=10-5mol/L时,溶液的c(OH-)=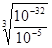 =10-9 mol/L,因此c(H+)=
=10-9 mol/L,因此c(H+)=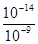 =10-5mol/L,所以pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5。
=10-5mol/L,所以pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5。
(5) Cr2O72—要生成Cr(OH)3沉淀,必需有还原剂,而铁做电极时,在阳极上可以失去电子产生Fe2+,电极反应式为Fe-2e-=Fe2+。
(6)在电解池中阳离子在阴极得到电子,在溶液中由于H+得电子得能力强于Fe2+的,因此阴极是H+放电,电极反应式为2H++2e-=H2↑。随着电解的进行,溶液中的H+浓度逐渐降低,水的电离被促进,OH-浓度逐渐升高。由于Fe2+被Cr2O72—氧化生成Fe3+,当溶液碱性达到一定程度时就会产生Fe(OH)3沉淀。
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题综合性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。注意相关知识的积累和总结,并能灵活运用即可。
