(1)25 ℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
①在该温度时,取l mol N2和3 mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是_______92.4 kJ。(填“小于”, “大于” 或“等于”)
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是_______________。
A.NH3生成的速率与NH3分解的速率相等
B.混合气体的反应速率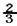 v正(NH3)=v逆(H2)
v正(NH3)=v逆(H2)
C.容器内的密度不再变化
D.单位时间内消耗a mol N2,同时生成2a mol NH3(2) 25 ℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0 mL,测得PH=11,则该条件下,NH3•H2O的电离平衡常数为__________。向此溶液中加入少量的氯化铵固体,此时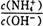 值将_____(填“增大”, “减小” 或“不变”)。
值将_____(填“增大”, “减小” 或“不变”)。
(3)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当PH=_________时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33)
(1)①小于 ….1分 ②A …. 2分
(2)10-5 ….2分 增大….1分 (3) 4 ….2分。
题目分析:(1)①因为可逆反应不可能完全进行到底,放出的热量比完全反应少,②A.氨的生成速率与氨的分解速率相等,正逆反应速率相等(同种物质),说明到达平衡状态,正确;B.混合气体的反应速率v正(NH3)=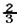 v逆(H2)时,各物质的浓度才能保持不变,错误;C.根据质量守恒,反应前后混合物的质量不变,容器的体积不变,所以密度始终不变,错误;D.单位时间内消耗n mol N2的同时必定生成2n mol NH3,不能说明反应v正=v逆,错误。
v逆(H2)时,各物质的浓度才能保持不变,错误;C.根据质量守恒,反应前后混合物的质量不变,容器的体积不变,所以密度始终不变,错误;D.单位时间内消耗n mol N2的同时必定生成2n mol NH3,不能说明反应v正=v逆,错误。
(2)氨水溶液PH=11,则C(H+)═10-11 mol•L-1,C(0H-)═10-3mol•L-1,
NH3•H2O ⇌ NH4++ OH-
起始(mol•L-1) 0.1 0 0
反应(mol•L-1) 10-3 10-3 10-3
平衡(mol•L-1) 0.1 10-3 10-3
所以NH3•H2O的电离平衡常数为Kb=(10-3×10-3)/0.1==1.0×10-5mol•L-1;故答案为:
1.0×10-5mol•L-1;向此溶液中加入少量的氯化铵固体,平衡逆向移动,c(NH4+)增大,c(OH-)减小,此时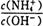 值将增大。
值将增大。
