在海底和青藏高原都发现了名为“可燃冰”的环保型新能源,主要成分是CH4,CH4在光照下可与Cl2反应,也可以用CH4和H2O为原料制备二甲醚和甲醇等新型燃料.
(1)CH4可与Cl2反应,其反应机理如下:
(2)Cl2→2Cl2△H=+243kJ•mol-1
①Cl2→2Cl △H=+243KJ• mol-1
②Cl+CH4→CH3+HCl △H=+4KJ•mol-1
③CH3+Cl2→CH3Cl+Cl △H=-106KJ•mol-1
则CH4与Cl2反应生成CH3Cl(g)的热化学方程式为:
(2)在一定条件下,发生反应:CH4(g)+H2O(g)

ClO(g)+3H2(g)△H>0.
在其它条件不变的情况下降低温度,逆反应速率将______(填“增大”、“减小”或“不变”).若在2L密闭容器中发生反应,T℃时,通入2mol CH4(g)和2mol H2O(g),反应达平衡后,生成l mol CO,此时向容器中同时加入1mol CO和3molH2的混合气体(保持温度不变),则平衡将______(填“向正反应方向”、“向逆反应方向”或“不”)移动,达到新平衡后平衡常数______
(3)CH4(g)和H2O(g)生成的CO和H2在一定条件下可发生反应CO(g)+2H2(g)

CH3OH(g)△H=-90.1kJ•mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有______.(选填序号).
a.再充入1mol H2 b.使用健化剂 c.再充入2mol CO d.升高温度
(4)CH4可用于设计燃料电池,甲烷燃料电池的工作原理如下图所示:

则正极的电极反应式为:______;
反应一段时间后溶液的pH______(填“升高”、“降低”或“不变”).
(1)根据盖斯定律反应CH4(g)+Cl2(g)=CH3Cl(g)+HCl(g)可看成反应②+③得到,则△H=△H②+△H③;
所以CH4与Cl2反应生成CH3Cl(g)的热化学方程式为:CH4(g)+Cl2(g)→CH3Cl(g)+HCl(g)△H=-102 kJ•mol-1,故答案为:CH4(g)+Cl2(g)→CH3Cl(g)+HCl(g)△H=-102 kJ•mol-1;
(2)因温度对正逆反应速率的影响一致,降低温度反应速率减小,故答案为:减小;
根据等效平衡可知压强增大,平衡向气体体积减小的方向移动,即向逆反应方向移动,T℃时,通入2mol CH4(g)和2mol H2O(g),反应达平衡后时,有
CH4(g)+H2O(g)
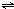
CO(g)+3H2(g)
起始(mol/L) 1 1 0 0
反应(mol/L) 0.5 0.5 0.5 1.5
平衡(mol/L) 0.5 0.5 0.5 1.5
所以平衡常数K=
=6.75,1.53×0.5 0.5×0.5
平衡常数只与温度有关,与物质的起始浓度无关,所以此时向容器中同时加入1mol CO和3molH2的混合气体(保持温度不变),达到新平衡后平衡常数仍然为6.75,故答案为:向逆反应方向;不变;
(3)a、再充入1mol H2,平衡向正反应方向移动,n(CH3OH)/n(CO)增大,故a正确;
b、使用催化剂,化学反应加快,但平衡不移动,n(CH3OH)/n(CO)不变,故b错误;
c、再充入2molCO,平衡虽然向正反应方向移动,n(CH3OH)、n(CO)的物质的量增大,但n(CO)增加得更多,二者比值减少,故c错误;
d、升高温度,平衡向逆反应方向移动,n(CH3OH)/n(CO)减小,故d错误;
故选:a;
(4)氧气得到电子,电极反应为:O2+4e-+2H2O=4OH-,该电池的反应式为2O2+CH4+2OH-═CO32-+3H2O,消耗了溶液中的氢氧根离子,且有溶剂水生成,导致溶液中氢氧根离子的浓度降低,故答案为:O2+4e-+2H2O=4OH-;降低;
