请回答下列问题:
(1)分别用浓、稀硝酸溶解等量的两份铜粉,消耗硝酸的物质的量较少的是____ 硝酸(填“浓”或“稀”),相应的离子方程式是 。
(2) 800℃时,在2 L的恒容密闭容器中充入2 mol NO和1mol O2发生反应,2NO(g)+O2(g) 2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。
2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。
①5 min内 v(O2)= 。
②该条件下,2NO(g)+O2(g) 2NO2(g)的△H= 。
2NO2(g)的△H= 。
③若向平衡混合物中再充入NO、NO21mol,此时v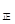 v
v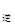 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
④若向平衡混合物中仅充入1mol NO2,平衡向____ (填“正向”、“逆向”或“不”)移动。达新平衡时,NO2的体积分数____ (填“增大”、“减小”或“不变”)。
(3)染料工业排放的废水中含有大量有毒的NO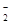 ,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____ 。
,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____ 。
(1)稀;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
(2)①0.05 mol/(L·min) ②-2Q kJ/mol ③= ④逆向;增大
(3)2Al+NO2-+OH-+2H2O=2AlO2-+NH3·H2O
试题解析:(1)浓硝酸还原产物为NO2,稀硝酸还原产物为NO,转移电子数相同时,稀硝酸的用量少。
(2)①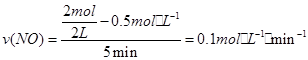 ,则v(O2)=0.05mol·L-1·min-1。
,则v(O2)=0.05mol·L-1·min-1。
②反应消耗NO:2mol-0.5mol/L×2L=1mol,放热QkJ,则消耗2molNO放热2QkJ。
③根据题中数据可知,平衡时NO、O2、NO2的物质的量浓度分别为0.5mol/L、0.25mol/L、0.5mol/L,则该温度下的平衡常数: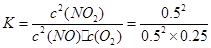 =4,加入NO、NO2各1mol,则NO、NO2浓度改变相同,因此Qc=K,平衡不移动,则正、逆反应速率相等。
=4,加入NO、NO2各1mol,则NO、NO2浓度改变相同,因此Qc=K,平衡不移动,则正、逆反应速率相等。
④充入NO2则产物浓度增大,平衡逆向移动。因NO2浓度增大,因此平衡时其体积分数增大。
(3)根据加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出可知有氨水生成,则Al失电子,NO2-得电子,根据氧化还原反应电子得失守恒及电荷守恒,可写出化学方程式。
