钢铁是21世纪用途最广的结构材料和功能材料。其成分主要是Fe和少量C。
(1)工业上在炼铁高炉中用CO热还原Fe2O3冶炼铁。写出该反应的化学方程式并用单线桥表示电子转移的方向和数目 。
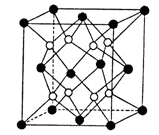
(2)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图(黑球代表Fe,白球代表Mg)。则铁镁合金的化学式为 。
(3)Fe3+的电子排布式为 ;CH3+微粒的中心原子杂化轨道类型为 ;
(4)向一定量的FeCl3溶液中加入适量KSCN溶液,溶液变红色。该反应体系中存在化学平衡 (用反应式表示);向上述红色溶液中加入Mg(OH)2固体,可观察到溶液红色变浅,有红褐色沉淀析出。试用平衡移动原理解释该现象 。(不考虑SCN—与Mg2+反应)
(1)
(2)FeMg2
(3)1S22S23S23P63d5 SP2
Fe2++3SCN- Fe(SCN-)3 (红色) 由于氢氧化铁的溶解度小于氢氧化镁的溶解度,向上述体系中加入氢氧化镁后,发生沉淀转化:氢氧化镁沉淀转化成氢氧化铁沉淀,消耗了三价铁离子,使Fe2++3SCN-
Fe(SCN-)3 (红色) 由于氢氧化铁的溶解度小于氢氧化镁的溶解度,向上述体系中加入氢氧化镁后,发生沉淀转化:氢氧化镁沉淀转化成氢氧化铁沉淀,消耗了三价铁离子,使Fe2++3SCN- Fe(SCN-)3 平衡向左移动,Fe(SCN-)3 减少。
Fe(SCN-)3 平衡向左移动,Fe(SCN-)3 减少。
题目分析:(1)根据元素守恒和质量守恒定律,不难写出相关化学方程式和画出单线桥;(2)利用均摊法,
Fe:8×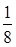 +6×
+6×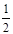 =4;Mg:8;得到铁镁合金化学式:FeMg2;(3)根据能量最低原理和核外电子排布原理,不难写出Fe3+,核外电子排布式;CH3+微粒的中心原子C,含有3δ,孤电子对数:
=4;Mg:8;得到铁镁合金化学式:FeMg2;(3)根据能量最低原理和核外电子排布原理,不难写出Fe3+,核外电子排布式;CH3+微粒的中心原子C,含有3δ,孤电子对数: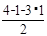 =0,
=0,
价层电子对数为4,杂化轨道类型SP2。(4)存在平衡Fe3++3SCN- Fe(SCN)3,根据勒夏特列原理不
Fe(SCN)3,根据勒夏特列原理不
难判断化学平衡的移动方向。
