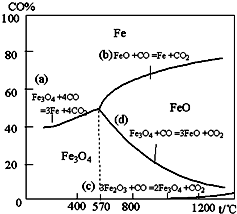
钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉冶炼,常用赤铁矿、焦炭、空气和熔剂(石灰石)作原料.已知赤铁矿被还原剂还原时是逐级进行的,还原时温度及CO、CO2平衡混合气体中CO的体积分数的关系如图:
(1)铁在元素周期表中位于______周期______族.
(2)在温度低于570℃时,还原分两阶段完成,在温度高于570℃时,依次发生的还原反应有:______(选用右图中的a、b、c、d填空).
(3)为减少高炉冶铁时,含CO的尾气排放,下列研究方向不可取的是______.
(a)其它条件不变,增加高炉的高度
(b)调节还原时的炉温
(c)增加原料中焦炭与赤铁矿的比例
(d)将生成的铁水及时移出
(4)已知下列反应数值:
| 反应序号 | 化学反应 | 反应热 |
| ① | Fe2O3(s)+3CO(g)=2Fe(s)+3CO 2(g) | △H1=-26.7kJ•mol-1 |
| ② | 3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) | △H2=-50.8kJ•mol-1 |
| ③ | Fe3O4(s)+CO(g)=3FeO(s)+CO2 (g) | △H3=-36.5kJ•mol-1 |
| ④ | FeO(s)+CO(g)=Fe(s)+CO2(g) | △H4 |
(5)1100℃时,FeO(s)+CO(g)⇌Fe(s)+CO2(g),平衡常数K=0.4.今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为:______.
(1)铁是26号元素,位于元素周期表中位于 第四周期第Ⅷ族.
故答案为:四、Ⅷ.
(2)由图可知在温度低于570℃时,发生反应bcd,由铁元素的化合价降低可知,依次发生的还原反应有
3Fe2O3+CO=2Fe3O4+CO2,Fe3O4+CO=3FeO+CO2,FeO+CO=Fe+CO2.故反应顺序为cdb.
故答案为:cdb.
(3)
(a)其它条件不变,增加高炉的高度,不影响平衡移动,不能减小一氧化碳的排放,故a错误;
(b)反应为吸热反应,调节还原时的炉温,有利于平衡向正反应进行,降低一氧化碳的含量,故b正确;
(c)焦炭与赤铁矿是固体,增加原料中焦炭与赤铁矿的比例,不影响平衡移动,不能减小一氧化碳的排放,故c错误;
(d)生成的铁水为液态,将生成的铁水及时移出,不影响平衡移动,不能减小一氧化碳的排放,故d错误.
故选:acd.
(4)已知:①Fe2O3(s)+3CO(g)=2Fe(s)+3CO 2(g)△H1=-26.7kJ•mol-1;
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H2=-50.8kJ•mol-1;
③Fe3O4(s)+CO(g)=3FeO(s)+CO2 (g)△H3=-36.5kJ•mol-1;
由盖斯定律可知,①×3-②-③×2得6FeO(s)+6CO(g)=6Fe(s)+6CO2(g)△H=3△H1-△H2-2△H1,
所以△H4=
△H=1 6
(3△H1-△H2-2△H1)=1 6
×[3×(-26.7kJ•mol-1)-(-50.8kJ•mol-1)-2×(-36.5kJ•mol-1)]=1 6
7.3kJ•mol-1.
故答案为:7.3.
(5)4.48LCO(已折合为标准状况)物质的量为
=0.2mol,令转化率的CO的物质的量为xmol,则:4.48L 22.4L/mol
FeO(s)+CO(g)⇌Fe(s)+CO2(g),
开始(mol):0.2 0
变化(mol):x x
平衡(mol):0.2-x x
一氧化碳的系数等于二氧化碳的系数,故可以用物质的量代替浓度计算平衡常数,
所以
=0.4,解得x=x 0.2-x
mol2 35
由方程式可知,转化的FeO的物质的量n(FeO)=n(CO)=
mol,2 35
所以FeO的转化率为
×100%=57.1%.
mol ×72g/mol2 35 7.2g
答:FeO的转化率为57.1%.
