问题
问答题
1840年盖斯根据一系列实验事实得出规律,他指出:“若是一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同.”这是18世纪发现的一条重要规律,称为盖斯定律.已知1mol 金刚石和石墨分别在氧气中完全燃烧时放出的热量为:金刚石,395.41kJ;石墨,393.51kJ.则金刚石转化石墨时,放热还是吸热?______,其数值是_______,由此看来更稳定的是______.若取金刚石和石墨混合晶体共1mol 在O2中完全燃烧,产生热量为QkJ,则金刚石和石墨的物质的量之比为______(用含Q的代数式表示).
答案
由盖斯定律可知,要得到金刚石转化为石墨的热量变化,可将二者在氧气中完全燃烧时放出的热量相减即可,
得C(金刚石)═C(石墨)△H=-395.41kJ/mol-(-393.51kJ/mol)=-1.90kJ/mol,
即金刚石转化为石墨放出热量,说明石墨的能量更低,比金刚石稳定,
金刚石和石墨混合晶体共1mol 在O2中完全燃烧,产生热量为QkJ,
由十字交叉法
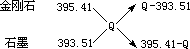
,
可得二者物质的量比为
,Q-393.51 395.41-Q
故答案为:放热;1.90kJ;石墨;
.Q-393.51 395.41-Q
