工业合成氨与制备硝酸一般可连续生产,流程如下:
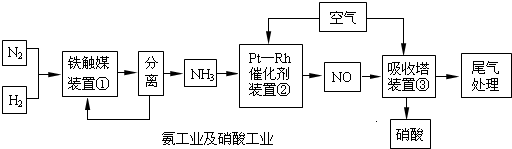
完成下列问题:
Ⅰ.合成氨
(1)写出装置①中发生反应的化学方程式:______.
(2)已知在一定的温度下进入装置①的氮、氢混合气体与从合成塔出来的混合气体压强之比为5:4,则氮的转化率为______.
Ⅱ.氨的接触氧化原理
(3)在900℃装置②中反应有:
4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g);△H=-905.5kJ•mol-1 K1=1×1053 (900℃)
4NH3(g)+4O2(g)⇌4N2O(g)+6H2O(g);△H=-1103kJ•mol-1 K2=1×1061 (900℃)
4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g);△H=-1267kJ•mol-1 K3=1×1067 (900℃)
除了上列反应外,氨和一氧化氮相互作用:
4NH3(g)+6NO(g)⇌5N2(g)+6H2O(g);△H=-1804kJ•mol-1,还可能发生氨、一氧化氮的分解.
完成热化学方程式:2NO(g)⇌N2(g)+O2(g);△H=______.
(4)铂-铑合金催化剂的催化机理为离解和结合两过程,如图所示:
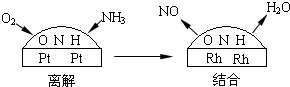
由于铂对NO和水分子的吸附力较小,有利于氮与氧原子结合,使得NO和水分子在铂表面脱附,进入气相中.若没有使用铂-铑合金催化剂,氨氧化结果将主要生成______.说明催化剂对反应有______.
(5)温度对一氧化氮产率的影响
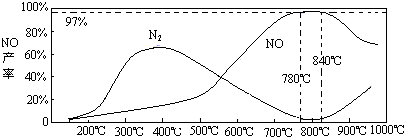
当温度大于900℃时,NO的产率下降的原因______(选填序号)
A.促进了一氧化氮的分解
B.促进了氨的分解
C.使氨和一氧化氮的反应平衡移动,生成更多N2
(6)硝酸工业的尾气常用Na2CO3溶液处理,尾气的NO、NO2可全部被吸收,写出用Na2CO3溶液吸收的反应方程式______.
(1)氮气的氢气在催化剂、加热加压的条件下生成氨气的反应为:N2+3H2
2NH3,故答案为:N2+3H2 催化剂 加热、加压
2NH3;催化剂 加热、加压
(2)设消耗的氮气的量是x,则N2 +3H2
2NH3催化剂 加热、加压
初始物质的量 1 3 0
变化的物质的量 x 3x 2x
平衡时的物质的量 1-x 3-3x 2x
氮、氢混合气体与从合成塔出来的混合气体压强之比为5:4,即氮、氢混合气体的物质的量之和与从合成塔出来的混合气体的物质的量之和的比为5:4,所以
=(1-x)+(3-3x)+2x 4
,解得x=0.4mol,所以氮气的转化率为:4 5
×100%=40%,故答案为:40%;0.4 1
(3)根据已知反应可得:①2NO(g)+3H2O(g)⇌2NH3(g)+
O2(g);△H=5 2
×905.5kJ•mol-1=452.75kJ•mol-1,1 2
②2NH3(g)+
O2(g)⇌N2(g)+3H2O(g);△H=-1267×3 2
kJ•mol-1=-633.5kJ•mol-1;1 2
反应2NO(g)⇌N2(g)+O2(g)可以看成是①+②的结果,所以△H=-633.5kJ•mol-1+452.75kJ•mol-1=-180.75 kJ•mol-1,故答案为:-180.75 kJ•mol-1;
(4)若没有使用铂-铑合金催化剂,氢气会和氧气反应,使得氮气和氢气不能反应,说明催化剂具有选择性,故答案为:氮气和水蒸气;选择性;
(5)由图象可知在温度较低时生成氮气.温度高于900℃时,NO产率下降是因为反应4NH3+5O2⇌4NO+6H2O是放热反应,达到平衡后,升温平衡逆向进行,故产率降低,
故答案为:A、B;
(6)尾气的NO、NO2可全部被碳酸钠吸收,其化学方程式为:NO+NO2+Na2CO3═2NaNO2+CO2、2NO2+Na2CO3═NaNO2+NaNO3+CO2,
故答案为:NO+NO2+Na2CO3═2NaNO2+CO2 、2NO2+Na2CO3═NaNO2+NaNO3+CO2.
