汽车内燃机工作时产生的高温会引起N2和O2发生反应生成NO气体,是导致汽车尾气中含有NO的原因之一.
(1)如图表示在T1、T2两种不同温度下,一定量的NO发生反应:2NO(g)⇌N2(g)+O2(g).反应过程中N2的体积分数随时间变化的图象.升高温度,该反应的平衡常数K将______(填“增大”、“减小”或“不变”).
(2)2000℃时,向容积为2L的密闭容器中充入10mol N2与5mol O2,达到平衡后NO的物质的量为2mol,则2000℃时该反应的平衡常数K的数值为______.该温度下,若开始时向上述容器中充入N2与O2均为1mol,则达到平衡后N2的转化率为______.
(3)研究发现,用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
若1mol CH4还原NO2至N2,整个过程中放出的热量为______kJ.
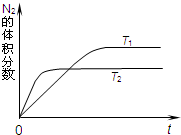
(1)根据“先拐先平数值大”知,T1<T2,升高温度氮气的体积分数减小,平衡向逆反应方向移动,反应物浓度增大,生成物浓度减小,平衡常数K减小;
故答案为:减小;
(2)利用三段式求出反应混合物各组分物质的量的变化量、平衡时反应混合物各组分物质的量.
N2(g)+O2(g)⇌2NO(g),
起始(mol):10 5 0
反应(mol):1 1 2
平衡(mol):9 4 2
所以平衡常数k=
=C2(NO) C(N2)C(O2)
=2mol 2L
.9mol 2L 4mol 2L 1 9
令N2转化的物质的量为xmol,则
N2(g)+O2(g)⇌2NO(g),
起始(mol):1 1 0
反应(mol):x x 2x
平衡(mol):1-x 1-x 2x
所以
=2xmol 2L
.(1-x)mol 2L (1-x)mol 2L 1 9
解得x=
,N2的转化率为1 7
×100%=14.3%;
mol1 7 1mol
故答案为:
(或0.11),1 9
(或14.3%);1 7
(3)设放出的热量为y.
将两个方程式CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1、CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1相加得:
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734kJ•mol-1
2mol 1734KJ
1mol y
y=867KJ
故答案为:867.
