熔融碳酸盐燃料电池是以熔融的碳酸盐为电解质的燃料电池,其工作原理如图所示:
(1)电极b是该燃料电池的(填“正”或“负”)______极.
(2)若以氢气为燃料,则A是(填化学式)______,Y是(填化学式)______;CO32-的移动方向是移向(填“电极a”或“电极b”)______;电极b的电极反应是______.
(3)若以一氧化碳为燃料,则反应非常慢,可通过反应CO+H2O=CO2+H2,使一氧化碳转化为氢气再进一步反应.
①已知25℃时,C(s)+
O2(g)═CO2(g)△H=-394kJ/mol:1 2
H2(g)+
O2(g)═H2O(g)△H=-242kJ/mol1 2
C(s)+O2(g)═CO(g)△H=-111kJ/mol则25℃时,CO(g)+H2O(g)═CO2(g)+H2(g)的反应热△H=______.
②已知反应CO(g)+H2O(g)⇌CO2(g)+H2(g)在某温度时的平衡常数是9.0.若反应开始时,一氧化碳和水蒸气的浓度都是0.01mol/L,则一氧化碳在此反应条件下的转化率是______.
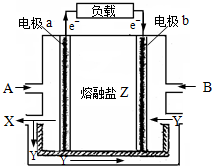
(1)在燃料电池中,电子由负极流行正极,根据图示内容:电子是从a流向b,可以知道电极b是该燃料电池的正极,故答案为:正;
(2)在燃料电池中,燃料做负极,氧气作正极,所以若以氢气为燃料,则A是氢气,根据:熔融碳酸盐燃料电池是以熔融的碳酸盐为电解质的燃料电池“可以知道Y是二氧化碳,在电池中,电解质中的阴离子移向负极,正极上是氧气得电子的还原反应,故答案为:H2;CO2;电极a;O2+4e-+2CO2═2CO32-;
①C(s)+
O2(g)═CO2(g)△H=-394kJ/mol;H2O(g)=H2(g)+1 2
O2(g),△H=242kJ/mol;CO(g)=C(s)+O2(g),△H=111kJ/mol,反应CO(g)+H2O(g)═CO2(g)+H2(g)可以看成是以上三个反应的和,所以反应CO(g)+H2O(g)═CO2(g)+H2(g)△H=-394kJ/mol+242kJ/mol+111kJ/mol=-41 kJ/mol,故答案为:-41 kJ/mol;1 2
②设消耗的一氧化碳浓度为c,则:
CO(g)+H2O(g)⇌CO2(g)+H2(g)
初始浓度:0.01 0.01 0 0
变化浓度:c c c c
平衡浓度:0.01-c 0.01-c c c
则有
=9,c2 (0.01-c)2
解得c=0.0025(mol/L),
一氧化碳在此反应条件下的转化率=
×100%=75%,1-0.0025 0.01
故答案为:75%.
