(甲醇是重要的化学工业基础原料和清洁液体燃料,它广泛用于有机合成、医药、农药、涂料、染料、汽车和国防等工业中。工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)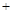 2H2(g)
2H2(g)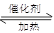 CH3OH(g)
CH3OH(g) Q
Q
下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(1)判断反应达到平衡状态的依据是( )
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
(2)由表中数据判断Q 0 (填“>”、“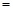 ”或“<”),要提高CO转化率,可采取的措施
”或“<”),要提高CO转化率,可采取的措施
是( )
A.加入催化剂 B.充入CO C.充入H2 D.升温
(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c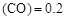 mol/L,则以CH3OH表示的反应速率v
mol/L,则以CH3OH表示的反应速率v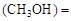 mol /(L·min),
mol /(L·min),
CO的转化率为 。
(4)原料CO和H2可以由C和H2O反应制取,涉及的反应方程式如下:
C(s)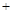 CO2(g)
CO2(g)  2CO(g) 平衡常数K1
2CO(g) 平衡常数K1
C(s)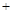 H2O(g)
H2O(g)  CO(g)
CO(g)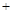 H2(g) 平衡常数K2
H2(g) 平衡常数K2
CO(g)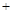 H2O(g)
H2O(g)  H2(g)
H2(g)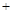 CO2(g) 平衡常数K3
CO2(g) 平衡常数K3
则K1、K2、K3之间的关系是: 。
(1)BD (2分)
(2)>(1分)、C (1分)
(3)0.08 (1分) 80% (1分)
(4)K2=K1·K3 (2分)
题目分析:
(1)A恒容密闭容器,体积不变,都是气体,质量守恒,混合气体的密度始终不变,不能做平衡标志,错误;B正确;C生成CH3OH和消耗CO的速率是同向速率,错误;D正确。
(2)由表可知,T升高,K减小,正反应是放热反应,Q>0。提高CO转化率,反应正向进行,选C。
(3) CO(g)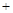 2H2(g)
2H2(g)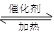 CH3OH(g)
CH3OH(g) Q
Q
初浓度: 1 3 0
变浓度 0.8 1.6 0.8
平衡 0.2
v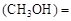 0.8/10=0.08(mol/L·min)
0.8/10=0.08(mol/L·min)
CO的转化率=" 0.8" /1*100%= 80%
(4)①C(s)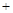 CO2(g)
CO2(g)  2CO(g) 平衡常数K1
2CO(g) 平衡常数K1
②C(s)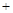 H2O(g)
H2O(g)  CO(g)
CO(g)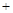 H2(g) 平衡常数K2
H2(g) 平衡常数K2
③CO(g)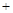 H2O(g)
H2O(g)  H2(g)
H2(g)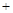 CO2(g) 平衡常数K3
CO2(g) 平衡常数K3
②=①+③ 所以K2=K1·K3
