氨是氮循环中的重要物质,在生产、生活和科研中有着广泛的应用.
(I)工业上利用氨来制备生产硝酸赝蔼要的一氧化氮,该反应的化学方程式为______
已知:Ⅰ.2NN3(g)+CO2(g)⇌NH2CO2NH4(s)△H=-159.47kJ•mol-1
Ⅱ.2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g)△H=-42.98kJ•mol-1
①反应NH2CO2NH4(s)⇌CO(NH2)2(s)+H2O(g)的△H=______
②一定条件下在密闭容器中发生反应Ⅰ,平衡后只改变一个条件.导致化学平衡常数变小,下列说法正确的是______(填序号).
a.改变的条件一定是减小压强
b.改变的条件一定是升高温度
c.反应速率减小,平衡一定向正反应方向移动
d.反应速率增大,平衡一定向逆反应方向移动
③-定条件下,将2molNH3和ImolC02充入容积为2L的密闭容器中发生反应Ⅱ.反应进行2min时,产生热量21.49kJ,则2min内该反应的反皮速率v(NH3)=______,此条件下该反应的化学平衡常数K=______.
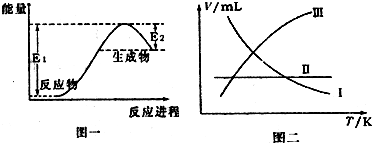
(3)图一为实验室制备NH3的能量变化图象,图二中的曲线表示产生氨气的体积随温度的变化趋势,其中正确的是______ (填写代号).
(1)用氨来制备生产硝酸的原料NO,是用氧气催化氧化氨气制备的,其反应方程为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2 高温 . 催化剂
4NO+6H2O; 高温 . 催化剂
(2)①根据盖斯定律计算:把方程Ⅰ反写,与方程Ⅱ相加即可求出)△H=159+(-42.98)=116.49kJ•mol-1,故答案为:116.49kJ•mol-1;
②衡后只改变一个条件.导致化学平衡常数变小,已知反应Ⅰ为放热反应,化学平衡常数变小,平衡逆方向移动,说明改变的条件一定是升高温度,所以反应速率增大,故答案为:bd;
③现根据热量求出参加反应的氨气的量n(NH3)=
×2=1mol,再根据反应速率公式求算v(NH3)=0.25mol•L-1•min-1;21.49kJ 42.98kJ•mol-1
2NH3 +CO2 ⇌CO(NH2)2(s)+H2O(g)
初始浓度(mol•L-1):1 0.5 0
反应浓度(mol•L-1):0.5 0.25 0.25
平衡浓度(mol•L-1):0.5 0.25 0.25
△K=
=c(H2O) c2(NH3)×c(CO2)
=4mol-2•L-1,故答案为:0.25mol•L-1•min-1,4mol-2•L-1;0.25 0.52×0.25
(3)根据图一可知实验室制备NH3的反应为吸热反应,因为实验室制备NH3的反应是不可逆反应,温度越高,生成的氨气越多,所以氨气的体积随温度的变化趋势为曲线Ⅲ,故答案为:Ⅲ.
