工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)⇌2NH3(g),其部分工艺流程如下:
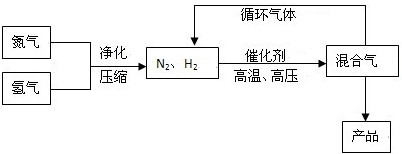
回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H=180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol
则N2(g)+3H2(g)⇌2NH3(g)的△H=______.
(2)如果工业上,在一定温度下,将1.5molN2 气体和6molH2 气体通入到体积为1升的密闭容器中.当反应达到平衡时,容器内气体的压强为起始时的80%,则氮气的转化率为______.该反应的平衡常数表达式为______,改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是______
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成份为氯化铵)生成.该反应的化学方程式为:______.
(4)假如该厂生产的氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH______14-a(填“大于”“小于”或“等于”)
(1)已知:①N2(g)+O2(g)=2NO(g);△H=180.5kJ/mol
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905kJ/mol
③2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol
由盖斯定律,①+③×
-②×3 2
得,N2(g)+3H2(g)⇌2NH3(g);△H=-92.4kJ/mol.1 2
故答案为:-92.4kJ/mol.
(2)反应达到平衡时,容器内气体的压强为起始时的80%,所以平衡时混合气体的物质的量为
(1.5mol+6mol)×80%=6mol.
对于反应:N2(g)+3H2(g)⇌2NH3(g) 物质的量减少△n
1 2
0.75mol (1.5mol+6mol)-6mol=1.5mol
所以平衡时氮气的转化率为
×100%=50%.0.75mol 1.5mol
平衡常数指生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,所以对于:
N2(g)+3H2(g)⇌2NH3(g)的反应平衡常数k=
.c2(NH3) c(N2)•c3(H2)
①反应为气体体积减小的反应,增大压强平衡向气体体积减小方向移动,即向正反应移动,平衡常数不变,故①正确;
②增大反应物的浓度,平衡向正反应移动,平衡常数不变,故②正确;
③使用催化剂,加快反应速率,平衡不移动,故③错误;
④合成氨是放热反应,降低温度,平衡向放热反应方向移动,即向正反应移动,但平衡常数增大,故④错误.
故答案为:50%;
;①②.c2(NH3) c(N2)•c3(H2)
(3)反应有氯化铵生成,氯元素的化合价降低,根据氧化还原反应,可知氮元素被氧化为氮气,反应方程式为
8NH3+3Cl2=N2+6NH4Cl.
故答案为:8NH3+3Cl2=N2+6NH4Cl.
(4)混合呈中性,则氯离子的浓度等于铵根离子浓度.pH=a的氨水,由于一水合氨是弱电解质,所以氨水的浓度大于
10-14+a,由于等体积混合,所以盐酸氯离子的浓度大于10-14+a,即盐酸中氢离子浓度大于10-14+a.所以盐酸的pH<14-a.
故答案为:小于.
