利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径.
(1)已知:CH4(g)+2O2 (g)=CO2 (g)+2H2O (l)△H=-890.3kJ•mol-1 ①
H2(g)+1/2O2 (g)=H2O (l)△H=-285.8kJ•mol-1 ②
CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1 ③
H2O(g)=H2O(l)△H=-44.0kJ•mol-1 ④
反应CH4(g)+H2O(g)
CO(g)+3H2(g),△H=______kJ•mol-1.标准状况下33.6L甲烷高温下与水蒸气完全反应生成CO和H2,反应过程中转移______mole-,放出______kJ热量. 高温 .
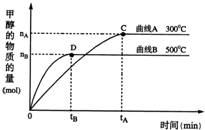
(2)一定条件下,在体积为5L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)⇌CH3OH(g).不同温度时甲烷的物质的量随时间变化曲线如图所示.根据题意完成下列各题:
①反应达到平衡时,平衡常数表达式K=______,降低温度,K值______(填“增大”、“减小”或“不变”).
②在300℃,从反应开始到平衡,氢气的平均反应速率v(H2)=______.(用相关符号和数据表示)
③判断该可逆反应达到平衡状态的标志是______.(填字母)
a.CH3OH的生成速率与CO的消耗速率相等 b.容器中气体的压强不变
c.容器中混合气体的密度保持不变 d.CO百分含量保持不变
e.CO和CH3OH浓度相等
④欲提高H2的转化率,下列措施可行的是______.(填字母)
a.向容器中再充入Ar b.改变反应的催化剂
c.向容器中再充入CO d.升高温度.
(1)由CH4(g)+2O2 (g)=CO2 (g)+2H2O (l)△H=-890.3kJ•mol-1 ①,
H2(g)+1/2O2 (g)=H2O (l)△H=-285.8kJ•mol-1 ②,
CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1 ③,
H2O(g)=H2O(l)△H=-44.0kJ•mol-1 ④,
根据盖斯定律可知,①+④-③-②×3可得CH4(g)+H2O(g)
CO(g)+3H2(g), 高温 .
其反应热△H=(-890.3kJ•mol-1)+(-44kJ•mol-1)-(-283.0kJ•mol-1)-(-285.8kJ•mol-1)×2=+206.1kJ/mol,
标准状况下33.6L甲烷,其物质的量为1.5mol,所以该反应中转移的电子数为1.5mol×(2+4)=9mol,
该反应放出的热量为1.5mol×206.1kJ/mol=309.15kJ,
故答案为:+206.1;9;309.15;
(2)①由CO(g)+2H2(g)⇌CH3OH(g),则平衡常数K=
,由图可知,温度高时甲醇的量少,则该反应为放热反应,降低温度,平衡正向移动,所以K增大,c(CH3OH) c(CO)•c2(H2)
故答案为:
;增大;c(CH3OH) c(CO)•c2(H2)
②由图可知,甲醇在0~tA时间内增加nAmol,则甲醇的反应速率为nA/5tA mol・(L・min)-1,再由化学计量数之比等于反应速率之比,所以氢气的反应速率为2nA/5tA mol・(L・min)-1,故答案为:2nA/5tA mol・(L・min)-1;
③a.CH3OH的生成速率与CO的消耗速率相等,只能确定正反应速率,不能确定正逆反应速率的关系,则不能判断平衡,故a错误;
b.该反应为反应前后压强不等的反应,则容器中气体的压强不变,达到平衡状态,故b正确;
c.因质量、体积不变,则容器中混合气体的密度始终保持不变,不能作为判断平衡的方法,故c错误;
d.CO百分含量保持不变,浓度不再变化,达到平衡状态,故d正确;
e.CO和CH3OH浓度相等,取决于起始量,不一定达到平衡,故e错误;
故答案为:bd;
④a.体积不变,向容器中再充入Ar,反应体系中各物质的浓度不变,平衡不移动,故a错误;
b.改变反应的催化剂,不影响化学平衡移动,故b错误;
c.向容器中再充入CO,平衡正向移动,提高氢气的转化率,故c正确;
d.升高温度提高,平衡逆向移动,H2的转化率减小,故d错误;
故答案为:c.
