I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g)△H
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1
②C(石墨)+CO2(g)=2CO(g)△H2,则△H=______(用含△H1、△H2代数式表示)
(2)高炉炼铁反应的平衡常数表达式K=______.
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
②下列说法正确的是______(填编号).
A.若容器压强恒定,反应达到平衡状态B.若容器内气体密度恒定,反应达到平衡状态
C.甲容器中CO的平衡转化率大于乙的D.增加Fe2O3就能提高CO的转化率
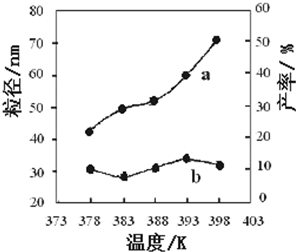
II.纳米MgO可用尿素与氯化镁合成.某小组研究该反应在温度为378~398K时的反应
时间、反应物配比等因素对其产率的影响.请完成以下实验设计表:
| 编号 | 温度/K | 反应时间/h | 反应物物质的量配比 | 实验目的 |
| ① | 378 | 3 | 3:1 | 实验②和④探究______ 实验②和______探究反应时间对产率的影响 |
| ② | 378 | 4 | 4:1 | |
| ③ | 378 | 3 | ______ | |
| ④ | 398 | 4 | 4:1 |
______.
I.(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1①
C(石墨)+CO2(g)=2CO(g)△H2②
由①-②×3,得到热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=△H1-3△H2,
故答案为:△H1-3△H2;
(2)反应Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g)的平衡常数K=
,故答案为:c3(CO2) c3(CO)
;c3(CO2) c3(CO)
(3)①令平衡时CO的物质的量变化为nmol,则:
Fe2O3(s)+3CO(g)⇌Fe(s)+3CO2(g)
开始(mol):11 1 1
变化(mol):nn n n
平衡(mol):1-n 1-n n n
所以K=
=c3(CO2) c3(CO)
=n3(CO2) n3(CO)
=64,解得n=0.6,所以CO的平衡转化率为n3 (1-n)3
×100%=60%,故答案为:60%;0.6mol 1mol
②②A、该反应是反应前后气体体积没有变化的反应,容器中的压强不再发生变化,不能证明达到了平衡状态,故A错误;
B、该容器的体积保持不变,根据质量守恒定律知,反应前后混合气体的质量会变,所以容器内气体的密度会变,当容器中气体的密度不再发生变化时,能表明达到化学平衡状态,故B正确;
C、该反应是反应前后气体体积没有变化的反应,增加反应物气体的物质的量平衡不发生移动,转化率不变,故C错误;
D、氧化铁是固体,增加Fe2O3的量,不影响平衡移动,故D错误;
故选:B.
II.实验根据控制变量法进行对比试验,研究温度、反应时间、反应物配比对氧化镁产率的影响.
实验①和③,温度相同,反应时间相同,应研究反应物配比对氧化镁产率的影响,③中反应物配比应为4:1;
实验②和④,反应时间相同,反应物配比相同,温度不同,应是探究温度对产率的影响;
③中反应物配比应为4:1,实验②和③,温度相同、反应物配比相同,反应时间不同,探究反应时间对产率的影响.
故答案为:4:1;温度对产率的影响;③;
由图表中数据可知,在378K~398K,纳米MgO的粒径大小无明显变化,在383K较低温度下有利于形成较小的颗粒,纳米MgO产率随温度的升高而增大.
故答案为:在378K~398K,纳米MgO的粒径大小无明显变化,在383K较低温度下有利于形成较小的颗粒,纳米MgO产率随温度的升高而增大.

