二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如图1:
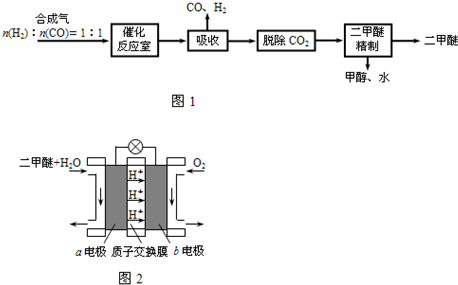
催化反应室中(压力2.0~10.0Mpa,温度300℃)进行下列反应:
①CO(g)+2H2(g)⇌CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2kJ/mol
(1)催化反应室中的总反应:3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g).
该反应的△H=______.催化反应室中采用300℃的反应温度,理由是______.
(2)已知:反应①在300℃时的化学平衡常数为0.27.该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此时反应将______(填“正向进行”、“逆向进行”或“处于平衡状态”).
(3)上述流程中二甲醚精制的实验操作名称为______.
(4)图2为绿色电源“二甲醚燃料电池”的工作原理示意图.a电极的电极反应式为______.
(1)已知:①CO(g)+2H2(g)⇌CH3OH(g)△H=-90.7kJ/mol,
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol,
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2kJ/mol,
由盖斯定律可知,①×2+②+③得3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)△H=-246.1kJ/mol,
反应放热,高温不利用原料的利用,温度低原料利用率高,但反应较慢,不利于实际生产,采用300℃的反应温度,目的提高化学反应速率.
故答案为:-246.1kJ/mol;提高化学反应速率;
(2)该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此时c(CO)=1mol/L,c(H2)=1.5mol/L,c(CH3OH)=1mol/L,浓度商Qc=
=0.44,大于平衡常数0.27,故反应向逆反应进行,故答案为:逆向进行;1 1×1.52
(3)二甲醚、乙醇、水为互溶的液体,沸点不同,采取蒸馏的方法将二甲醚分离,故答案为:蒸馏;
(4)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电.由图可知,a极为负极,二甲醚放电生成二氧化碳与氢离子,a电极的电极反应式为 CH3OCH3-12e-+3H2O=2CO2+12H+,故答案为:CH3OCH3+3H2O-12e-=2CO2+12H+.
