为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.
(1)①把含有较高浓度CO2的空气通入饱和K2CO3溶液.
②在①的吸收液中通高温水蒸气得到高浓度的CO2气体.
写出②中反应的化学方程式______.
(2)如将CO2与H2 以1:3的体积比混合.
①适当条件下合成某烃和水,该烃是______(填序号).
A.烷烃 B.烯烃 C.炔烃 D.苯的同系物
②适当条件下合成燃料甲醇和水.在体积为2L的密闭容器中,充入 2mol CO2和6mol H2,一定条件下发生反应:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ/mol.
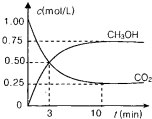
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
从反应开始到平衡,v(H2)=______;氢气的转化率=______;能使平衡体系中n(CH3OH)增大的措施有______.
(3)如将CO2与H2 以1:4的体积比混合,在适当的条件下可制得CH4.已知:
CH4 (g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ/mol
H2(g)+1/2O2(g)═H2O(l)△H2=-285.8kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是______.
(4)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表.
| 溶解度(S)/g | 溶度积(Ksp) | ||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 |
吸收CO2最合适的试剂是______(填“Ca(OH)2”或“Ba(OH)2”)溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定______.
(1)①中碳酸钾吸收二氧化碳生成碳酸氢钾,通高温水蒸气,碳酸氢钾分解生成碳酸钾、二氧化碳与水,反应方程式为:2KHCO3
K2CO3+H2O+CO2↑, △ .
故答案为:2KHCO3
K2CO3+H2O+CO2↑; △ .
(2)①设CO2与H2 的物质的量分别为1mol、3mol,根据O原子守恒可知生成H2O为2mol,故生成的烃中C原子与H原子的物质的量之比为1mol:(3mol×2-2mol×2)=1:2,故该烃的最简式为CH2,符合烯烃的通式,
故答案为:B;
②由图可知,10min达平衡,平衡时甲醇的浓度变化为0.75mol/L,v(CH3OH)=
=0.075mol/(L•min),根据速率之比等于化学计量数之比,故v(H2)=3v(CH3OH)=3×0.075mol/(L•min)=0.225mol/(L•min),0.75mol/L 10min
平衡时△n(CH3OH)=0.75mol/L×2L=1.5mol,根据方程式可知△n(H2)=3△n(CH3OH)=3×1.5mol=4.5mol,所以氢气的转化率为
×100%=75%,4.5mol 6mol
该反应正反应是体积减小的放热反应,故降低温度或加压或增大H2的量等,可以是平衡向正反应移动,增大CH3OH的物质的量,
故答案为:0.225mol/(L•min),75%,降低温度(或加压或增大H2的量等);
(3)已知:①CH4 (g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ/mol
②H2(g)+1/2O2(g)═H2O(l)△H2=-285.8kJ/mol
由盖斯定律,②×4-①得CO2(g)+4H2(g)═CH4 (g)+2H2O(l)△H=-252.9 kJ/mol
故答案为:CO2(g)+4H2(g)═CH4 (g)+2H2O(l)△H=-252.9 kJ/mol;
(4)碳酸钙与碳酸钡的溶度积形成不大,用沉淀法测定含有较高浓度CO2的空气中CO2的含量,故吸收二氧化碳的吸水剂溶解度应该较大,若溶解性减小,会导致二氧化碳吸收不完全,故选择氢氧化钡吸收二氧化碳,
通过沉淀法测定废气中二氧化碳的含量,二氧化碳转化为碳酸钡沉淀,根据碳酸钡的质量可以确定二氧化碳的体积,实验时除需要测定工业废气的体积外,还需要测碳酸钡的质量,
故答案为:Ba(OH)2,BaCO3的质量.
